常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-07-08 09:05:37 细胞资源库平台 访问量:260
同源异体小鼠肿瘤模型是免疫肿瘤学(I/O)研究中不可或缺的临床前模型,但它们对免疫检查点抑制剂(ICIs)的反应有限,这可能是由于它们的固有低免疫原性。为了解决这一问题,研究人员通过将鸡卵清蛋白(OVA)这一高度免疫原性的蛋白质表达到同源异体肿瘤细胞中,开发了新的免疫原性同源异体模型。这些模型,如DC2.4-OVA和B16-OVA,显示出比它们的亲本细胞系更慢的肿瘤生长速度,这可能是由于免疫介导的排斥反应。更重要的是,这些OVA表达的模型对ICIs,特别是抗PD-1治疗,表现出更高的敏感性,这表明它们在增强T细胞介导的免疫反应方面具有潜力。此外,通过过继T细胞转移实验,研究人员验证了这些模型中存在肿瘤特异性记忆T细胞。这些结果表明,OVA工具细胞不仅增强了对ICIs的反应,而且为临床前免疫治疗评估提供了新的、具有更高免疫原性的同源异体模型,这对于I/O研究具有重要的意义。
英文标题:The potential role of CMC1 as an immunometabolic checkpoint in T cell immunity
中文标题:CMC1 作为 T 细胞免疫中免疫代谢检查点的潜在作用
发表期刊:《OncoImmunology》
影响因子:6.3
作者单位:
a. Jinshan Hospital Center for Tumor Diagnosis & Therapy, Jinshan Hospital, Fudan University, Shanghai, China
b. Shanghai Key Laboratory of Lung Inflammation and Injury, Zhongshan Hospital, Fudan University, Shanghai, China
c. Institute of Metabolism and Regenerative Medicine, Shanghai Sixth People’s Hospital Affiliated to Shanghai Jiao Tong University School of Medicine, Shanghai, China
d. Center of Emergency and Critical Medicine, Jinshan Hospital of Fudan University, Shanghai, China
作者信息:
Yuwen Chena*, Jie Gaob*, Mingyue Mac*, Ke Wanga*, Fangming Liub, Feiyu Yangd, Xin Zoua, Zhouli Chenga, and Duojiao Wua,b
T 细胞免疫在人体防御应答中至关重要,探索其关键分子可为免疫治疗提供新靶点。CMC1 作为线粒体电子传递链复合体 IV 的分子伴侣蛋白,既往研究发现其在肝细胞癌患者 CD8+ 耗竭 T 细胞中表达上调,但在 T 细胞活化与耗竭中的作用尚不明确。本研究基于 T 细胞活化依赖线粒体代谢重编程、肿瘤微环境(TME)中乳酸积累可能调控 T 细胞功能的科学问题,旨在揭示 CMC1 作为免疫代谢检查点的潜在机制。
研究通过构建 Cmc1 基因敲除(KO)小鼠和 B16-OVA 肿瘤模型,结合体外 T 细胞短期 / 长期刺激模型,采用 RT-qPCR、流式细胞术、Western blot、免疫沉淀及 ChIP-seq 等方法,分析 CMC1 在 CD8+ T 细胞活化、分化及耗竭中的作用。机制研究发现,环境乳酸通过诱导 USP7 介导的去泛素化稳定 CMC1 蛋白;体内实验证实,Cmc1 缺失可缓解瘤内 T 细胞耗竭,增强抗肿瘤免疫。
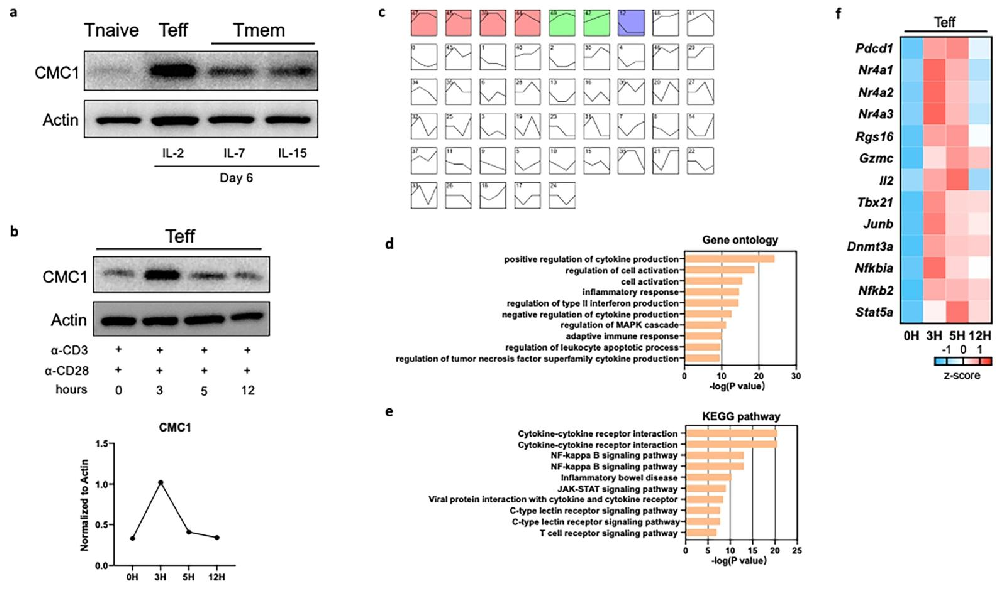
图1:CMC1 与 T 细胞活化事件相关
通过蛋白质表达与转录组分析,发现 CMC1 在效应 T 细胞(Teff)中高表达,且与 T 细胞活化、凋亡相关基因(如 Pdcd1、Nr4a1)共表达,提示其参与 T 细胞功能调控。
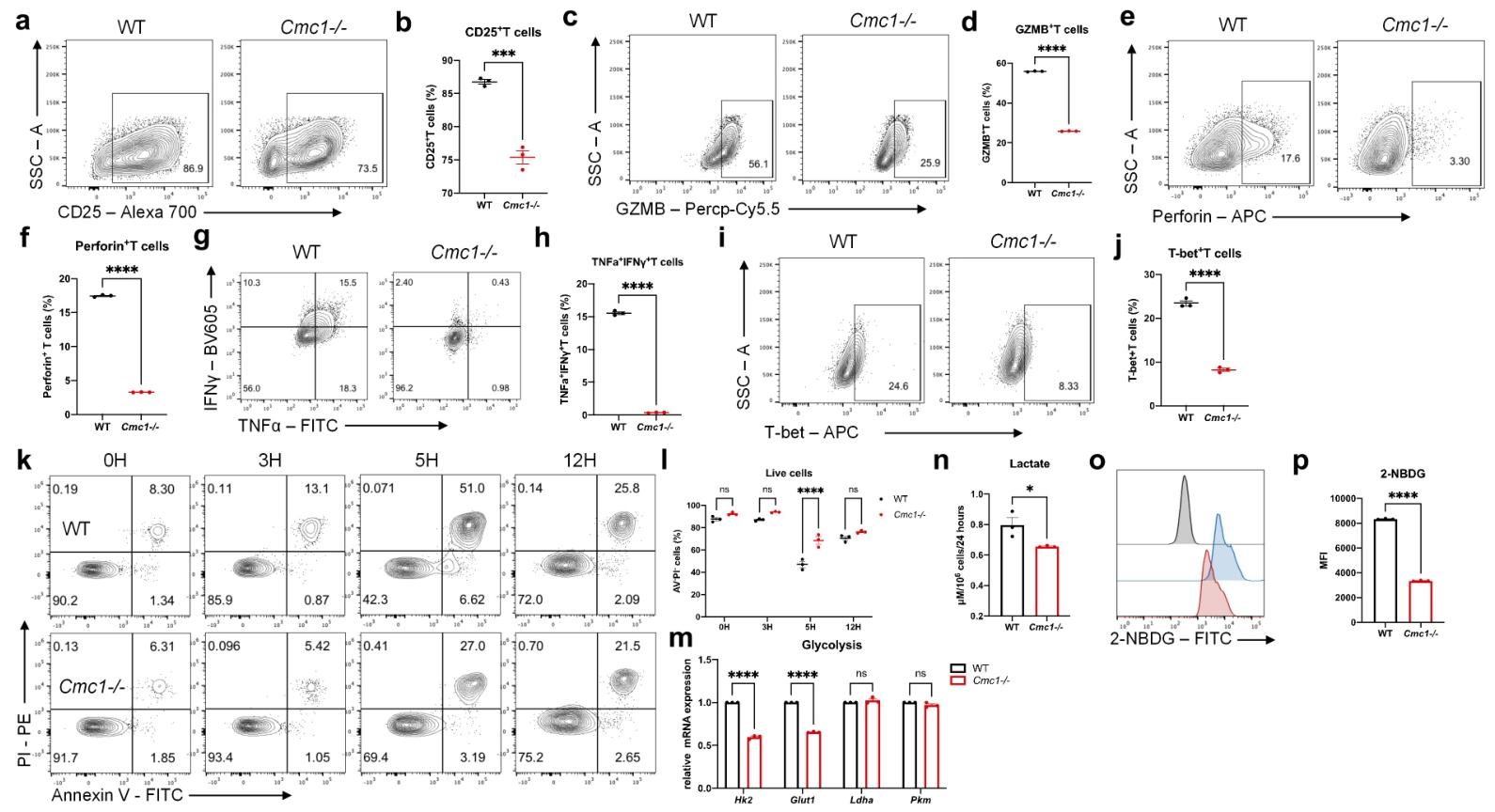
图2:CMC1 加速 CD8⁺ Teff 细胞活化与凋亡
Cmc1 KO 导致 Teff 细胞活化标志物(CD25、IFNγ 等)表达降低,糖酵解相关基因(Glut1、Hk2)下调,乳酸生成减少,细胞凋亡增加,证实 CMC1 是 T 细胞活化的正向调节因子。
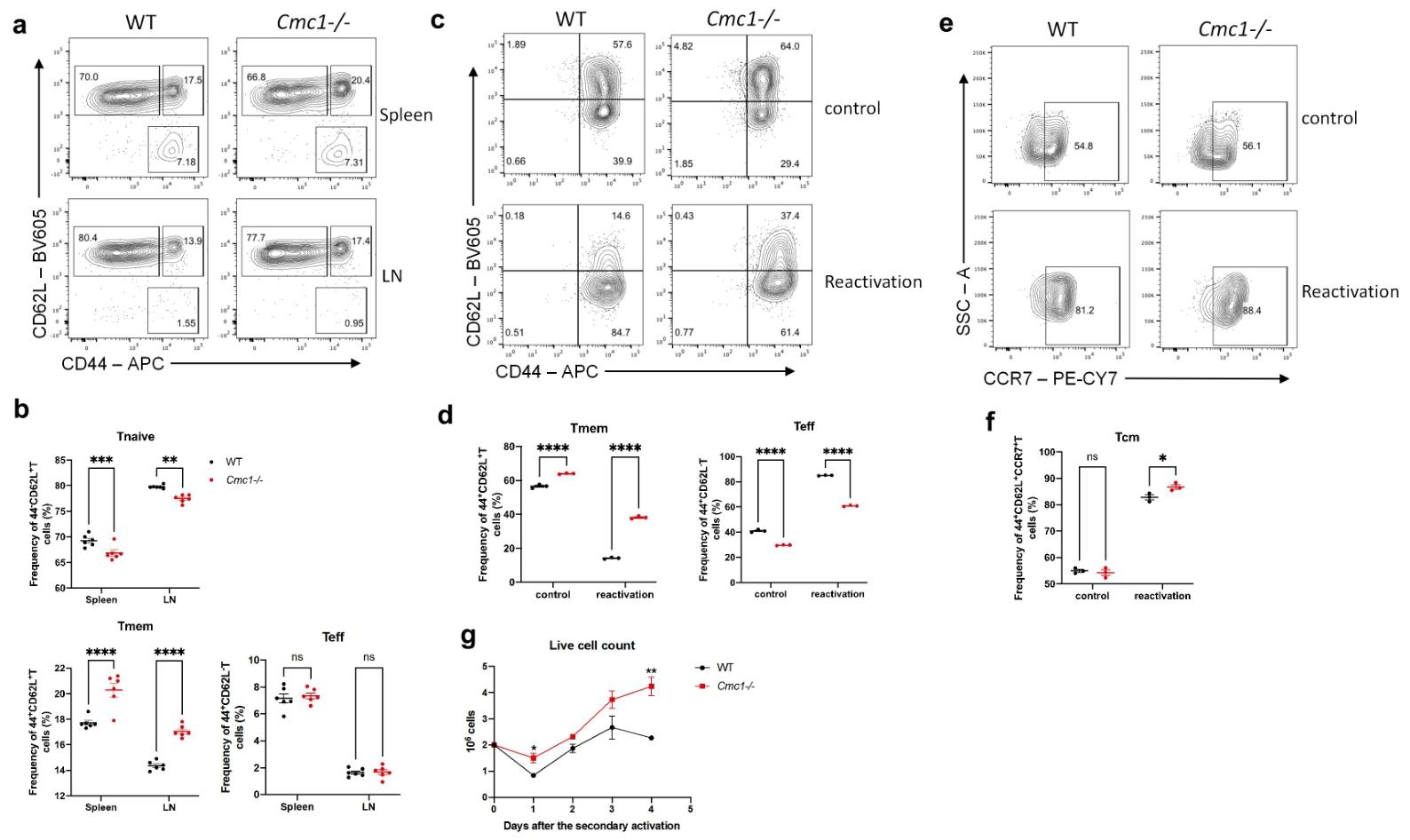
图3:CMC1 负向调节 T 细胞干性与记忆可塑性
Cmc1 KO 促进记忆样 T 细胞(CD44⁺ CD62L⁺)形成,增强二次刺激后的存活能力,表明 CMC1 缺失可维持 T 细胞记忆表型。
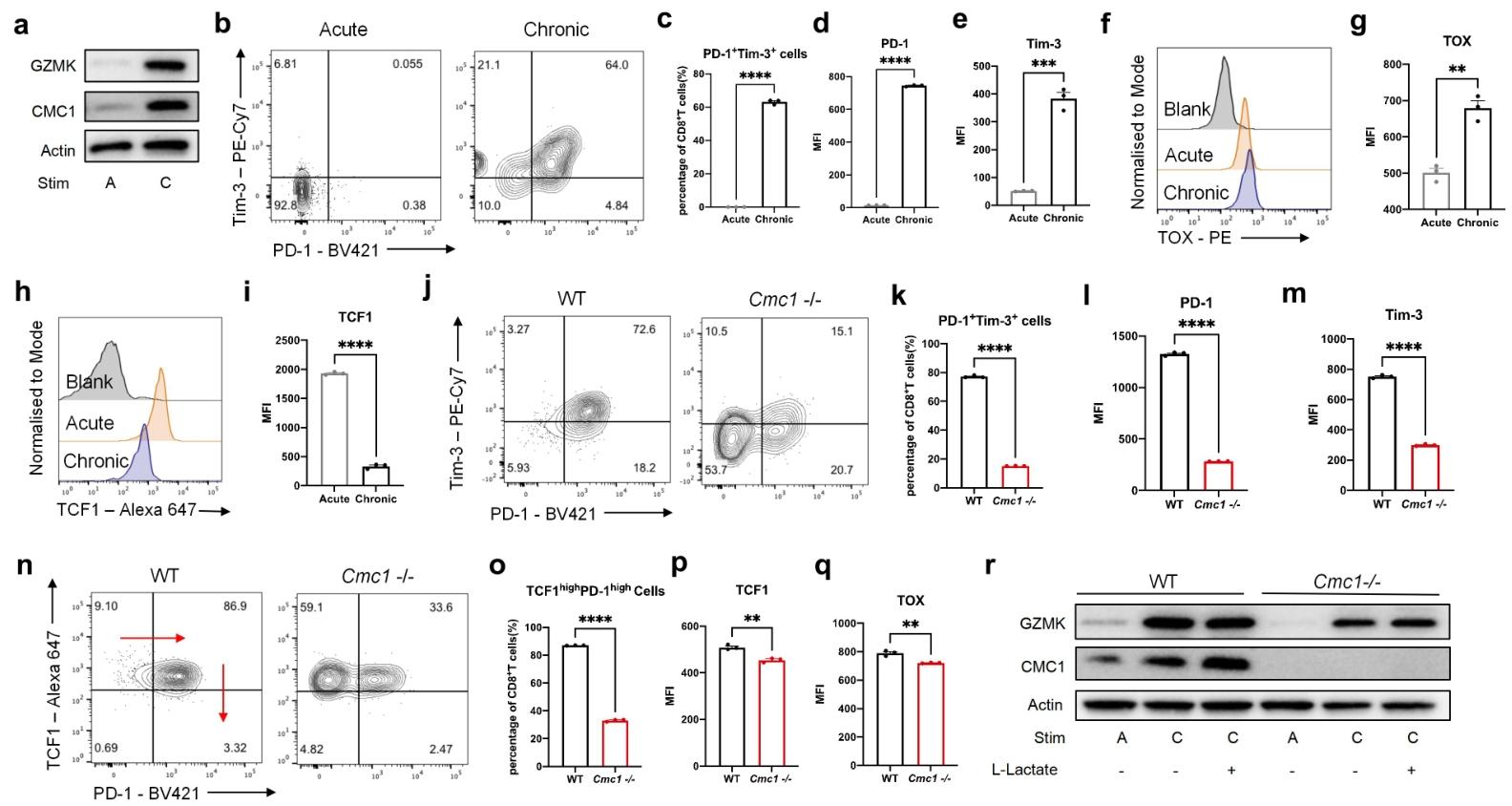
图4:CMC1 加速体外慢性刺激下的 T 细胞耗竭
慢性刺激诱导 CMC1 高表达,伴随耗竭标志物(PD-1、Tim-3)升高;Cmc1 KO 减少耗竭细胞比例,维持祖细胞标志物(TCF1)表达,提示 CMC1 推动 T 细胞向终末耗竭分化。
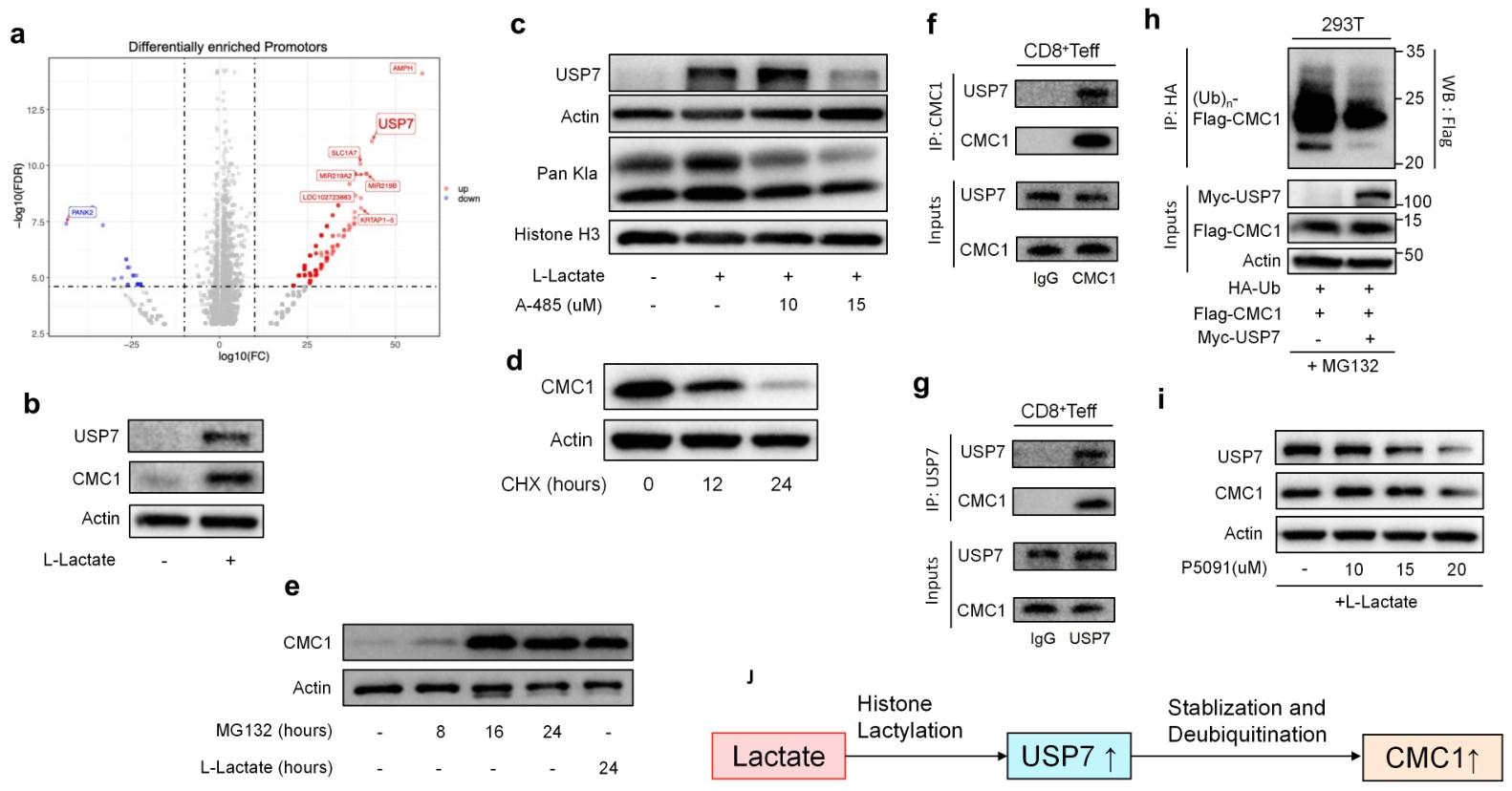
图5:乳酸通过 USP7 post-translationally 调控 CMC1
乳酸通过组蛋白乳酸化修饰激活 USP7,促进 CMC1 去泛素化稳定表达;抑制 USP7(P5091)可逆转乳酸诱导的 CMC1 积累,揭示 TME 中乳酸 - USP7-CMC1 调控轴。
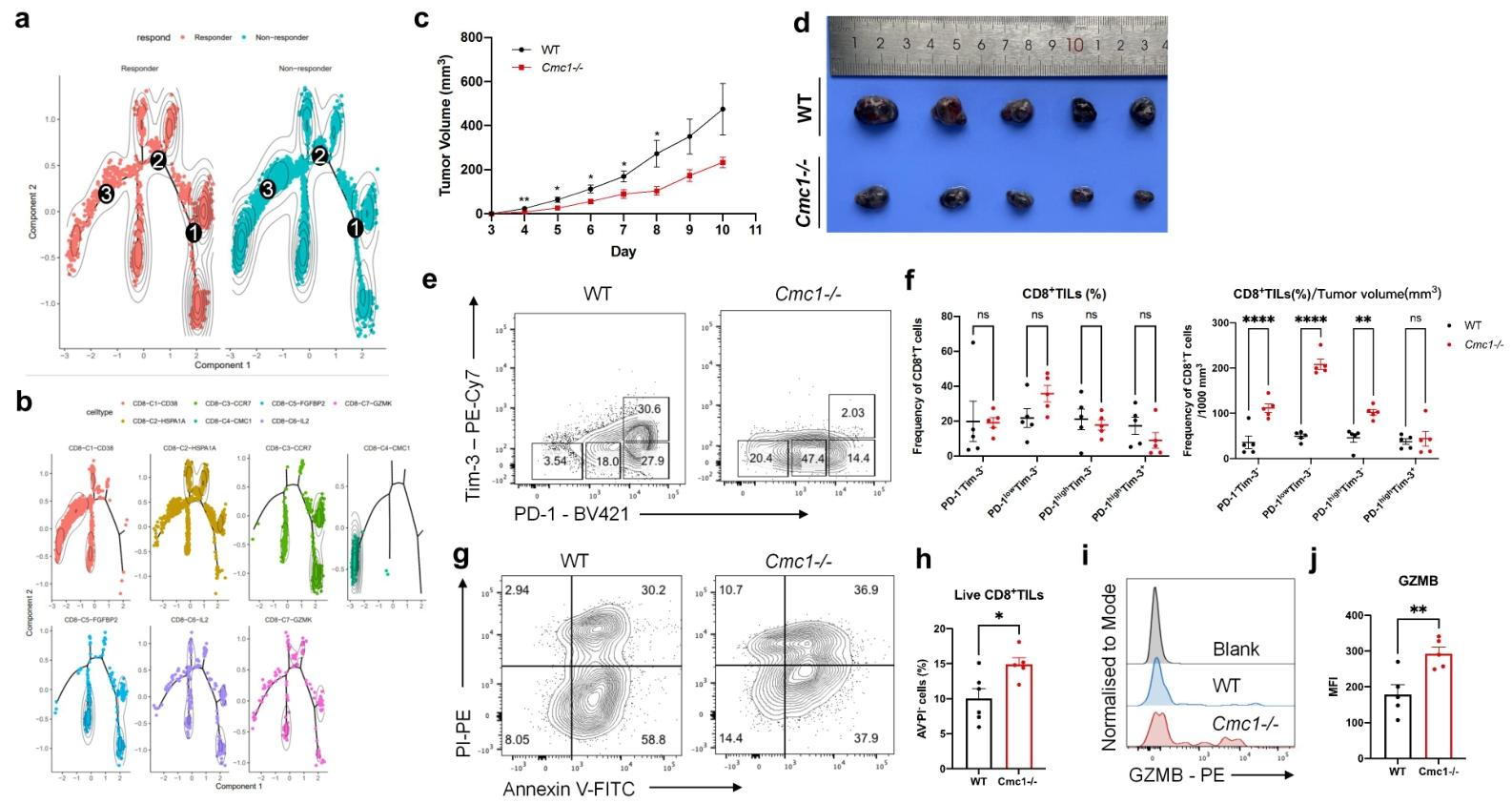
图6:Cmc1 缺失缓解瘤内 CD8⁺ T 细胞耗竭
Cmc1 KO 小鼠肿瘤生长减缓,瘤内耗竭 T 细胞(PD-1⁺Tim-3⁺)减少,效应分子(GZMB)表达增加,证实 CMC1 缺失可增强抗肿瘤免疫。
本研究首次证实 CMC1 是 CD8+ T 细胞活化和终末分化的正向调节因子,其缺失可抑制 T 细胞耗竭,促进记忆样 T 细胞形成。机制上,TME 中乳酸通过 USP7 介导的去泛素化修饰稳定 CMC1,驱动 T 细胞功能失调。体内实验显示,Cmc1 缺失可减缓肿瘤生长,增强瘤内 T 细胞杀伤功能。该研究揭示了 CMC1 作为免疫代谢检查点的新角色,为靶向 T 细胞代谢改善肿瘤免疫治疗提供了新思路。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:靶向抗癌的化合物竟是检测干扰剂?这项研究揭开药物筛选的 "障眼法"
下一篇:科学家开发出精准预测 HBV 清除的免疫模型,多中心验证 + 动物实验揭示关键机制