常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-05-07 17:32:04 细胞资源库平台 访问量:216
英文标题:SOX4 facilitates brown fat development and maintenance through EBF2-mediated thermogenic gene program in mice
中文标题:SOX4通过EBF2介导的产热基因程序促进小鼠棕色脂肪的发育和维持
发表期刊:《Cell death and differentiation》
影响因子:13.7
作者单位:
细胞应激生物学国家重点实验室,细胞信号网络创新中心,教育部分子诊断工程研究中心
厦门大学附属第一医院厦门心血管病研究所心脏电生理重点实验室
厦门大学医学院健康与医学数据科学国家研究所
中国科学院深圳先进技术研究院
作者信息:
Shuai Wang;Ting He;Ya Luo;Kexin Ren;Huanming Shen;Lingfeng Hou;Yixin Wei;Tong Fu;Wenlong Xie;Peng Wang;Jie Hu;Yu Zhu;Zhengrong Huang;Qiyuan Li;Weihua Li;Huiling Guo;Boan Li
棕色脂肪的研究
大量研究表明,代谢活跃的棕色脂肪存在于婴儿和成人中,并且人类BAT活动的增加与体重下降相关。因此,促进BAT的发展和功能可能是对抗肥胖及相关代谢紊乱的一种有前途的策略。
棕色脂肪的调控因子
几种转录调控因子已被证明参与了BAT的发展和功能。先前的谱系研究表明,经典的棕色脂肪细胞来源于在胚胎发育过程中表达En1、Pax3、Pax7和Myf5的多能祖细胞。在BAT发育过程中,这些祖细胞发展为前脂肪细胞,随后通过转录级联分化为棕色脂肪细胞。早期B细胞因子2(EBF2)是棕色脂肪细胞命运的关键转录调控因子。它能够招募过氧化物酶体增殖物激活受体-γ(PPARγ),这是一种在脂肪细胞分化过程中关键的转录因子,到其棕色特异性结合位点,以维持BAT身份。去除对EBF2的抑制作用可以增强白色脂肪细胞的产热潜力。最近的研究表明,EBF2增强了ERRα/PGC1α复合物的转录活性,以促进产热基因的表达并维持BAT的核心温度。这些发现表明EBF2对于棕色脂肪细胞分化和产热功能至关重要。然而,EBF2的转录调控因子仍然未知。
SOX4的作用
SRY相关高迁移率组盒转录因子4(SOX4)是Sox C家族的一员,包含高迁移率组DNA结合域(HMG-Box域)和C端转录激活域(TAD域)。它在调节细胞干性、细胞分化以及神经系统、内分泌岛和心脏的发育中起关键作用。我们发现SOX4不仅抑制WAT中的前脂肪细胞决定,而且在长期寒冷暴露期间作为PPARγ的共激活因子促进米色脂肪细胞的形成。
SOX4与棕色脂肪
尽管棕色和米色脂肪分化的调控涉及一组重叠的泛脂肪生成和BAT特异性转录在现有研究中,SOX4在决定棕色脂肪细胞命运中的潜在作用尚不明确。我们发现,SOX4通过促进Ebf2的转录,对小鼠的褐色脂肪组织发育和产热功能至关重要,这一过程可能受到PKA激活的促进。
研究意义
我们的研究揭示了SOX4在调控产热基因程序中的调节作用和机制,并表明靶向SOX4可能是对抗肥胖以提高能量消耗的一种潜在策略。
实验动物与饲养条件
小鼠种类为C57BL/6遗传背景的雄性,在22–24°C温度、50–60%湿度、12小时光照/黑暗周期下群居笼中饲养。
饮食条件
小鼠分别接受含67.4%碳水化合物、20.6%蛋白质、12%脂肪的普通饮食,或含20%碳水化合物、20%蛋白质、60%脂肪的高脂饮食。
免疫组化和免疫荧光
使用HE染色、免疫荧光和免疫组化技术对小鼠组织进行染色和观察,以研究特定蛋白的表达和定位。
透射电子显微镜
通过透射电子显微镜技术观察小鼠BAT组织的超微结构。
身体成分分析
使用Echo MRI组成分析仪评估小鼠的脂肪和瘦肉质量。
红外热成像和耐寒测试(CTT)
通过红外热成像和耐寒测试来评估小鼠的体温调节能力。
基因表达分析
使用定量PCR和RNA-Seq技术分析小鼠组织中基因的表达水平。
细胞培养与脂肪细胞分化
在体外培养小鼠BAT前脂肪细胞,并通过特定培养基诱导其分化为成熟的棕色脂肪细胞。
油红O染色和甘油三酯测量
通过油红O染色观察细胞内脂滴的形成,并测量甘油三酯水平以评估脂肪细胞的脂肪积累。
棕色脂肪细胞氧消耗率(OCR)测定
使用XF96 Extracellular Flux Analyzer测定分化后的棕色脂肪细胞的氧消耗率,以评估其代谢活性。
腺病毒的构建、纯化和注射
构建并纯化携带Sox4基因的腺病毒,并将其注射到小鼠BAT中以实现SOX4的过表达。
腺相关病毒(AAV)的包装和纯化
构建并纯化携带SOX4基因的腺相关病毒,通过尾静脉注射到小鼠体内以实现SOX4的过表达。
荧光素酶报告基因实验
构建荧光素酶报告基因质粒,通过转染细胞和测定荧光素酶活性来研究基因启动子的活性。
染色质免疫沉淀(ChIP)和ChIP测序分析
通过ChIP技术结合高通量测序分析SOX4蛋白在基因组中的结合位点。

Sox4-MKO小鼠构建:通过Myf5-Cre小鼠与Sox4f/f小鼠交配,特异性地在BAT中敲除Sox4基因。
SOX4蛋白水平降低:Sox4-MKO小鼠的BAT、iWAT和gWAT中SOX4蛋白水平显著降低。
BAT形态学改变:Sox4-MKO小鼠的BAT组织形态发生改变,脂滴大小显著减小。
胚胎BAT发育异常:E15.5 Sox4-MKO胚胎的肩胛间BAT区域发育异常,SOX4和UCP1表达降低。
ob/ob小鼠BAT变化:ob/ob小鼠BAT中SOX4和UCP1蛋白及mRNA水平均降低。
饮食影响BAT:高脂饮食喂养的小鼠BAT中SOX4和UCP1表达降低。
年龄影响BAT:随着年龄增长,小鼠BAT中SOX4和UCP1表达降低。

Sox4-MKO新生鼠产热不足:Sox4-MKO新生鼠在冷暴露下皮肤温度降低,表明产热能力受损。
Sox4-MKO成鼠体温调节受损:Sox4-MKO成鼠在冷暴露后核心体温下降,血糖和血清游离脂肪酸水平升高,BAT中甘油三酯含量降低。
Sox4-MKO成鼠能量代谢降低:Sox4-MKO成鼠在冷暴露下氧消耗和热量产生降低,对β3-肾上腺素能受体激动剂的反应减弱。
Sox4-BKO新生鼠产热不足:Sox4-BKO新生鼠在冷暴露下皮肤温度降低,表明产热能力受损。
Sox4-BKO成鼠体温调节受损:Sox4-BKO成鼠在冷暴露后核心体温下降,血糖和血清游离脂肪酸水平升高,BAT中甘油三酯含量降低。
Sox4-BKO成鼠能量代谢降低:Sox4-BKO成鼠在冷暴露下氧消耗和热量产生降低。
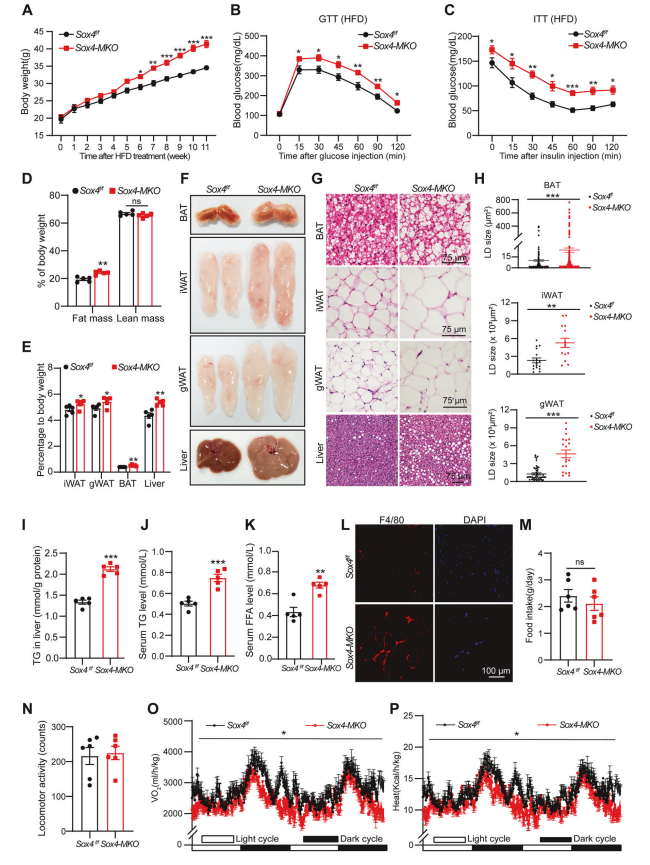
Sox4-MKO小鼠对高脂饮食更易感:Sox4-MKO小鼠在高脂饮食喂养下体重增加更多,显示出对肥胖的易感性。
葡萄糖耐量受损:Sox4-MKO小鼠在葡萄糖耐量测试中血糖水平更高,表明葡萄糖代谢受损。
胰岛素耐量受损:Sox4-MKO小鼠在胰岛素耐量测试中血糖水平更高,表明胰岛素敏感性降低。
脂肪质量和分布改变:Sox4-MKO小鼠的脂肪质量和瘦肉质量比例改变,BAT、iWAT、gWAT和肝脏的重量与体重比例增加。
脂肪组织形态学改变:Sox4-MKO小鼠的脂肪组织显示脂滴增大,炎症标记物F4/80表达增加。
代谢活动降低:Sox4-MKO小鼠的食物摄入量、运动活动、氧消耗和产热均降低,表明整体代谢活动下降。
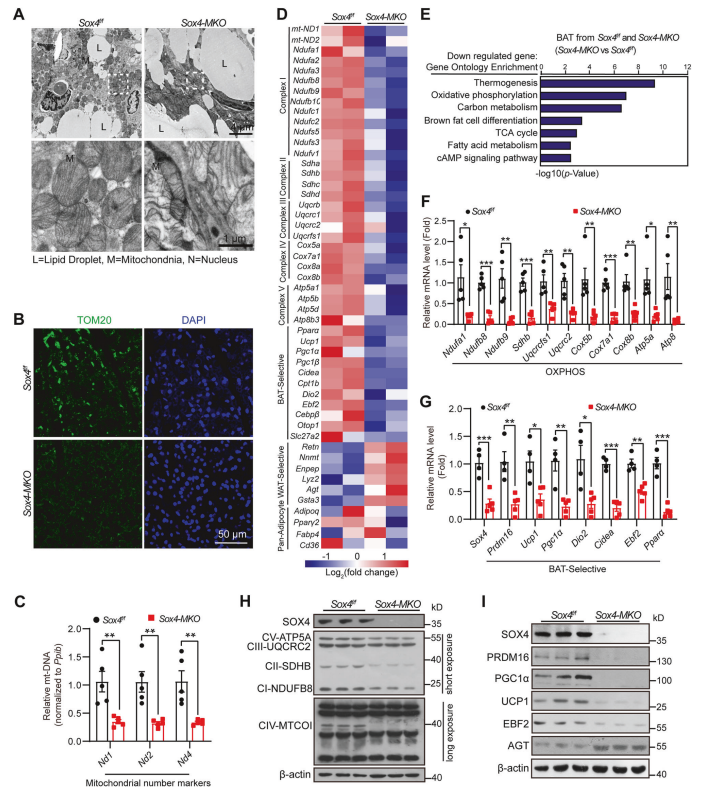
Sox4-MKO小鼠BAT超微结构改变:透射电子显微镜显示Sox4-MKO小鼠的BAT中线粒体数量减少,脂滴增大。
线粒体蛋白表达降低:免疫荧光和qPCR分析显示Sox4-MKO小鼠BAT中TOM20和线粒体DNA的转录本表达降低。
RNA测序揭示基因表达变化:RNA测序和热图分析显示Sox4-MKO小鼠BAT中大量基因表达下调,包括线粒体功能和脂肪代谢相关基因。
线粒体功能基因表达降低:RT-PCR分析显示Sox4-MKO小鼠BAT中线粒体复合物基因表达降低。
BAT特异性基因表达降低:RT-PCR分析显示Sox4-MKO小鼠BAT中多个BAT特异性基因表达降低。
蛋白水平降低:Western blot分析显示Sox4-MKO小鼠BAT中SOX4、线粒体呼吸链成分、BAT特异性蛋白和AGT蛋白的表达降低。

Sox4在棕色脂肪细胞分化中的必要性:通过慢病毒介导的shRNA技术,在体外抑制Sox4表达,发现Sox4对于棕色脂肪细胞的分化是必需的。
Sox4缺失影响脂肪积累:Sox4缺失导致分化后的棕色脂肪细胞中脂滴减少,甘油三酯含量降低。
BAT特异性基因表达降低:Sox4缺失导致棕色脂肪细胞中BAT特异性基因的mRNA水平显著降低。
WAT特异性基因表达增加:Sox4缺失导致棕色脂肪细胞中WAT特异性基因的mRNA水平增加。
蛋白水平降低:Sox4缺失导致棕色脂肪细胞中BAT富集蛋白和AGT蛋白的表达降低。
线粒体数量减少:Sox4缺失导致棕色脂肪细胞中线粒体DNA的转录本表达降低。
氧消耗率降低:Sox4缺失导致棕色脂肪细胞的氧消耗率降低,表明其代谢活性下降。

RNA测序与基因本体分析:RNA测序数据显示Sox4-MKO和Ebf2-AKO BAT中重叠下调基因,基因本体分析揭示与BAT发育相关基因显著下调。
ChIP测序结果:ChIP测序显示SOX4在Ebf2启动子上游-4k处显著富集结合,表明直接调控关系。
ChIP分析:ChIP分析证实SOX4蛋白在BAT SVF中Ebf2启动子上游-4k处有显著占用。
萤光素酶活性实验:NIH3T3细胞中,SOX4转染显著增强野生型pGL4.26-EBF2载体的萤光素酶活性,突变载体无此效应。
Ebf2启动子转录活性:NIH3T3细胞中,SOX4显著提高Ebf2启动子的相对转录活性,ΔHMG和ΔTAD突变体活性降低。
FAIRE实验:BAT SVF细胞感染shSOX4慢病毒后,Ebf2启动子区域的染色质开放性降低。
免疫荧光分析:E15.5 Sox4f/f和Sox4-MKO胚胎中,Sox4-MKO胚胎的EBF2表达显著降低。
UMAP图:E10.5到E13.5小鼠胚胎间充质和骨骼肌细胞的UMAP图显示BAT发育区域的细胞簇。
发育阶段细胞突出显示:UMAP图中根据发育阶段起源突出显示细胞。
Sox4和Ebf2表达模式:不同细胞簇中Sox4和Ebf2的表达模式显示其相关性。
平均表达水平:E10.5到E13.5小鼠胚胎中Ebf2和Sox4的平均表达水平显示其协同变化。
人类iPSCs分化表达:人类iPSCs分化为棕色脂肪细胞过程中,Sox4和Ebf2的mRNA表达水平同步变化。

免疫染色实验:BAT SVF细胞在不同培养基中处理1小时后,免疫染色显示SOX4的核定位变化。
ChIP-Seq分析:对照组和3X HA-SOX4表达的BAT SVF细胞在不同培养基中处理,ChIP-Seq分析显示SOX4在Ebf2启动子上的结合模式及新发基序。
免疫荧光实验:BAT SVF细胞经不同处理(DMSO、佛司可林、H89)后,佛司可林刺激显示SOX4蛋白核转位增强。
ChIP-qPCR:未处理或佛司可林处理的BAT SVF中,SOX4在Ebf2启动子上的占有率显著增加。
RT-qPCR分析:Sox4-MKO和对照小鼠的BAT SVF细胞经佛司可林处理后,Ebf2 mRNA水平显著变化。
冷暴露实验:Sox4f/f和Sox4-MKO小鼠在冷暴露后,BAT中Ebf2的表达水平显著不同。
萤火虫报告基因实验:不同处理的BAT SVF细胞中,Ebf2增强子的转录活性显著变化。
质谱分析:HEK293T细胞共转染WT-PRKACA或KD-PRKACA与HA-SOX4,质谱分析显示SOX4磷酸化位点。
氨基酸残基比对:不同物种SOX4残基S325及其相邻氨基酸残基的比对。
免疫荧光实验:NIH3T3细胞转染Flag-SOX4(WT或S235A突变体),佛司可林处理后SOX4核转位变化。
qPCR分析:NIH3T3细胞转染Flag-SOX4(WT或S235A突变体),佛司可林处理后Ebf2 mRNA水平变化。
机制图解:佛司可林诱导PKA激活,SOX4在S235处磷酸化,核转位后与EBF2合作激活EBF2转录。
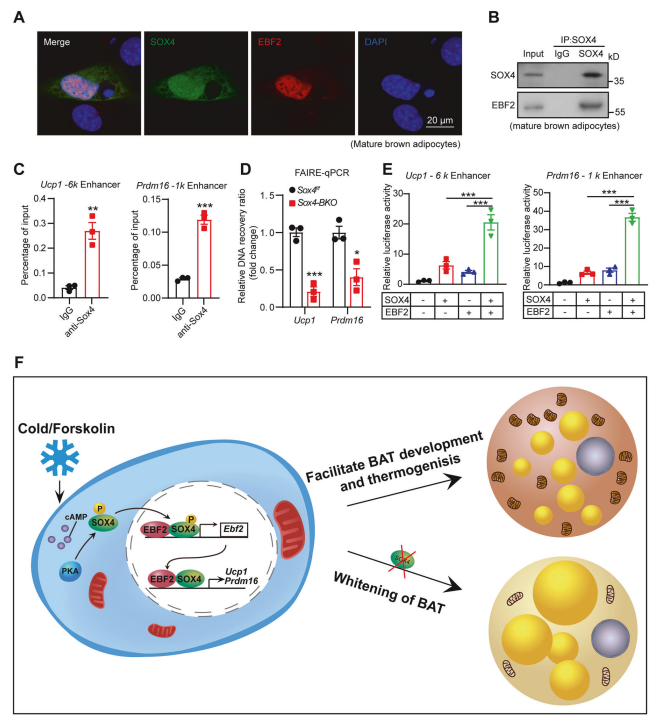
免疫荧光分析:SOX4和EBF2在成熟BAT脂肪细胞核中共定位,提示功能相互作用。
免疫沉淀和Western blot分析:抗SOX4抗体免疫沉淀验证了SOX4与EBF2的物理结合。
ChIP实验:SOX4在Ucp1和Prdm16基因启动子区域显著占有率,表明直接转录调控。
FAIRE实验:Sox4-BKO小鼠在Ucp1和Prdm16启动子上游区域的DNA富集减少,影响染色质开放状态。
转录活性评估:SOX4和EBF2共同过表达显著增强Ucp1和Prdm16启动子的转录活性。
示意图模型:冷刺激或福司可林激活PKA,磷酸化SOX4促进核定位,与EBF2协同增强产热基因转录。
1. SOX4对BAT发育和产热的重要性
SOX4是BAT发育和产热程序的必需因子。
Sox4-MKO和Sox4-BKO小鼠在冷暴露时出现BAT变白和体温过低。
2. Sox4-MKO小鼠的产热能力降低
Sox4-MKO小鼠产热能力下降,易受饮食诱导的肥胖影响。
3. SOX4过表达增强产热
BAT中过表达SOX4可增强产热,对抗饮食诱导的肥胖。
4. SOX4通过激活EBF2转录调控棕色脂肪命运
SOX4通过激活EBF2的转录决定棕色脂肪细胞的命运。
5. PKA磷酸化SOX4促进核内转移和EBF2转录
PKA在S235位点磷酸化SOX4,促进其核转位和EBF2的转录。
6. SOX4与EBF2合作激活产热基因转录程序
SOX4与EBF2共同激活调控产热基因表达的转录程序。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:肝癌患者的福音!新型基因疗法通过PET成像实现‘追踪式’打击
下一篇:肝癌放疗更精准!MRI新技术助力规避肝功能损伤,患者安全再升级