常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-04-10 09:25:07 细胞资源库平台 访问量:238
同源异体小鼠肿瘤模型是免疫肿瘤学(I/O)研究中不可或缺的临床前模型,但它们对免疫检查点抑制剂(ICIs)的反应有限,这可能是由于它们的固有低免疫原性。为了解决这一问题,研究人员通过将鸡卵清蛋白(OVA)这一高度免疫原性的蛋白质表达到同源异体肿瘤细胞中,开发了新的免疫原性同源异体模型。这些模型,如DC2.4-OVA和B16-OVA,显示出比它们的亲本细胞系更慢的肿瘤生长速度,这可能是由于免疫介导的排斥反应。更重要的是,这些OVA表达的模型对ICIs,特别是抗PD-1治疗,表现出更高的敏感性,这表明它们在增强T细胞介导的免疫反应方面具有潜力。此外,通过过继T细胞转移实验,研究人员验证了这些模型中存在肿瘤特异性记忆T细胞。这些结果表明,OVA工具细胞不仅增强了对ICIs的反应,而且为临床前免疫治疗评估提供了新的、具有更高免疫原性的同源异体模型,这对于I/O研究具有重要的意义。
英文标题:Critical Role of the Th1/Tc1 Circuit for the Generation of Tumor-Specific CTL during Tumor Eradication In Vivo by Th1-Cell Therapy
中文标题:Th1细胞疗法在体内肿瘤根除过程中Th1/Tc1回路对肿瘤特异性CTL生成的关键作用
发表期刊:《Cancer Science 》
影响因子:4.5
作者单位:
1. Division of Immunoregulation
2. Section of Disease Control
3. Institute for Genetic Medicine, Hokkaido University
作者信息:
Kenji Chamoto, Akemi Kosaka, Takemasa Tsuji
肿瘤免疫治疗的关键挑战在于如何有效诱导肿瘤特异性细胞毒性T细胞(CTL)。Th1和Th2细胞分别通过分泌IFN-γ和IL-4调控免疫应答,但二者在肿瘤微环境中的作用机制尚不明确。本研究旨在阐明Th1和Th2细胞在根除肿瘤过程中如何调控Tc1(IFN-γ+细胞毒性)和Tc2(IL-4+非细胞毒性)亚群。通过OVA特异性TCR转基因小鼠模型,研究者发现Th1细胞通过激活Th1/Tc1回路诱导肿瘤特异性CTL,而Th2细胞依赖Th2/Tc2回路诱导肿瘤坏死但缺乏长期免疫记忆。此外,研究探索了联合化疗药物环磷酰胺(CY)增强Th1细胞疗法的潜力。
动物模型:BALB/c小鼠接种表达OVA的A20淋巴瘤细胞(A20-OVA)建立肿瘤模型。
细胞治疗:从OVA特异性TCR转基因小鼠(DO11.10)分离CD4+ CD45RB+初始T细胞,体外诱导分化为Th1(IL-12+抗IL-4)或Th2(IL-4+抗IFN-γ)。
功能分析:将Th1/Th2细胞过继转移至肿瘤小鼠,分析脾细胞再刺激后的细胞因子(ELISA)和细胞毒性(51Cr释放实验)。
联合治疗:评估环磷酰胺(CY)与Th1细胞联合使用的疗效。
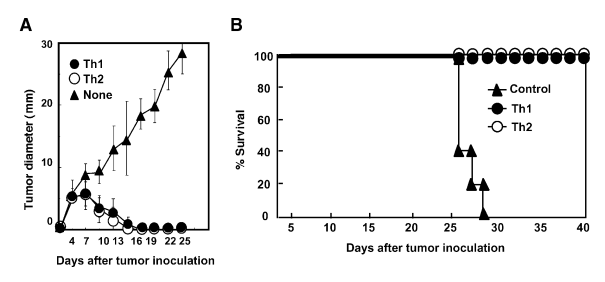
图1:Th1和Th2细胞疗法对A20-OVA肿瘤的抑制作用
实验通过将表达OVA抗原的A20淋巴瘤细胞(A20-OVA)接种至BALB/c小鼠体内建立肿瘤模型,待肿瘤生长至6-8 mm后,分别过继转移2×10⁷个OVA特异性Th1或Th2细胞。结果显示,Th1和Th2治疗组均能完全清除肿瘤,小鼠生存率显著提高(100%长期存活>60天),而对照组肿瘤持续生长并导致小鼠死亡。该结果首次证明Th1和Th2细胞疗法在肿瘤根除中具有同等效力,但后续实验揭示两者机制存在本质差异:Th1依赖细胞免疫(CTL介导杀伤),而Th2依赖坏死性炎症反应(如IL-4诱导的嗜酸性粒细胞浸润)。
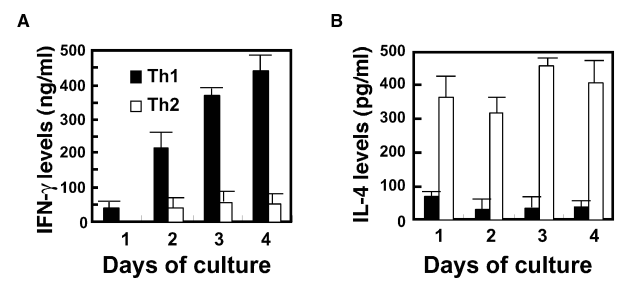
图2:Th1或Th2治疗后脾细胞再刺激的细胞因子动力学
从Th1或Th2治疗痊愈的小鼠中分离脾细胞,用OVA抗原体外再刺激4天,每日检测培养上清中IFN-γ和IL-4水平。结果显示,Th1治疗组的脾细胞在再刺激后持续分泌高浓度IFN-γ(第4天达峰值约800 pg/ml),而IL-4几乎无分泌;相反,Th2治疗组的脾细胞主要分泌IL-4(第4天约300 pg/ml),IFN-γ水平极低。这一动态变化表明,Th1治疗诱导了抗原特异性Th1/Tc1极化,而Th2治疗偏向Th2/Tc2极化,提示体内免疫记忆的分化方向由初始治疗的T细胞亚型决定。
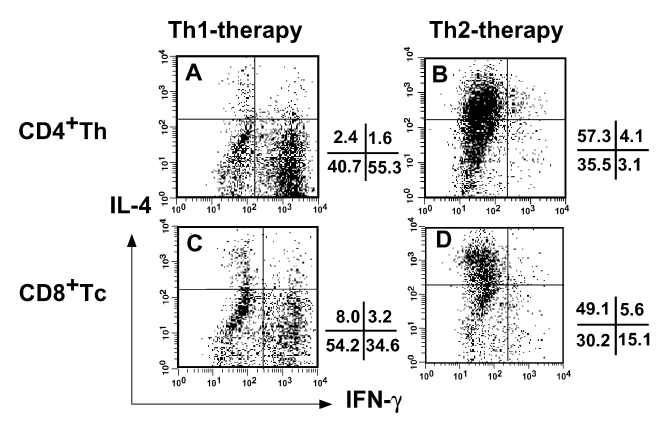
图3:Th1和Th2治疗后CD4+及CD8+ T细胞的细胞因子分泌特征
通过细胞内染色技术分析再刺激后T细胞的表型,发现Th1治疗组的CD4+ T细胞中90%以上为IFN-γ+ Th1细胞,CD8+ T细胞中34.6%为IFN-γ+ Tc1(仅8%为IL-4+);而Th2治疗组的CD4+ T细胞中超过80%为IL-4+ Th2细胞,CD8+ T细胞中49.1%为IL-4+ Tc2(仅15.1%为IFN-γ+)。这一结果直接证实了Th1/Tc1和Th2/Tc2的免疫极化现象,并表明CD8+ Tc1的生成依赖于Th1细胞的体内辅助作用,而Th2细胞无法有效激活CTL毒性。
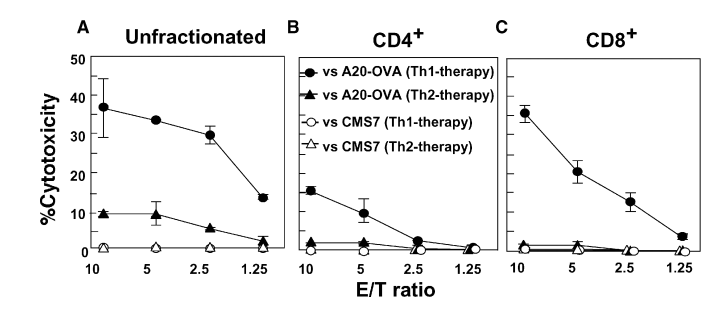
图4:Tc1而非Tc2介导肿瘤特异性细胞毒性
从Th1或Th2治疗痊愈小鼠中分离的脾细胞经OVA再刺激后,分选CD4+和CD8+ T细胞进行体外杀伤实验。结果显示,Th1治疗组CD8+ Tc1对A20-OVA肿瘤细胞具有显著特异性杀伤活性(效靶比50:1时杀伤率约60%),但对无关肿瘤CMS-7无作用;而Th2治疗组的CD8+ Tc2几乎无杀伤能力(效靶比50:1时<10%)。此外,Th1治疗组的CD4+ T细胞(Th1)也表现出微弱杀伤活性(约15%),可能与分泌IFN-γ直接抑制肿瘤生长有关。该数据明确了Tc1是Th1疗法中肿瘤根除的直接效应细胞,而Tc2不具备功能性细胞毒性。
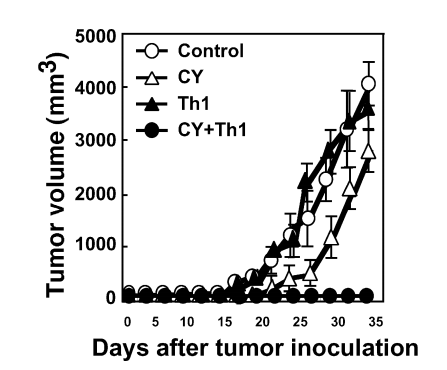
图5:环磷酰胺(CY)联合Th1疗法增强抗肿瘤效果
在A20-OVA肿瘤模型中,单独使用低剂量Th1细胞(5×10⁶)无法抑制肿瘤生长,但联合环磷酰胺(CY,40 mg/kg单次腹腔注射)后,肿瘤迅速消退并完全清除。联合治疗组的肿瘤体积在治疗8天后缩小至不可检测水平,而单独Th1组肿瘤持续进展。机制上,CY可能通过以下途径增强疗效:(1)清除免疫抑制性调节T细胞(Treg);(2)诱导肿瘤微环境中巨噬细胞从IL-10分泌型(M2)向IFN-γ分泌型(M1)转化;(3)促进Th1细胞体内扩增。这一发现为“化疗-免疫联合治疗”策略提供了实验依据,表明CY可突破Th1疗法的剂量限制,提升临床可行性。
Th1细胞通过激活Th1/Tc1回路诱导高水平的IFN-γ和肿瘤特异性CTL(Tc1),有效清除肿瘤并建立免疫记忆;而Th2细胞通过Th2/Tc2回路诱导IL-4+ Tc2,虽引起肿瘤坏死但缺乏细胞毒性。联合CY显著增强Th1疗法的抗肿瘤效果,提示“化疗-免疫联合治疗”可通过增强Th1/Tc1回路实现肿瘤根除。该研究为基于Th1的肿瘤免疫治疗提供了理论依据。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:大脑和肌肉老得更快?科学家首次发现‘翻译错误’的器官差异
下一篇:肝癌治疗新靶点安全获证!靶向URI1不会加剧乙肝病毒复制