常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-04-09 09:30:00 细胞资源库平台 访问量:207
英文标题:Membrane Fusion-Mediated Loading of Therapeutic siRNA into Exosome for Tissue-Specific Application
中文标题:通过膜融合将治疗性siRNA装载到外泌体中用于组织特异性应用
发表期刊:《ADVANCED MATERIALS》
影响因子:27.4
作者单位:
首上海交通大学化学与化工学院
前沿科学中心分子转化研究实验室
上海手性药物分子工程重点实验室
复旦大学附属眼耳鼻喉科医院眼科部门
聚合物分子工程国家重点实验室
复旦大学附属儿科医院眼科部门
近视及相关眼病国家卫生委员会重点实验室
上海市合成免疫学工程研究中心
作者信息:
Xie Miao;Wu Yuqing;Zhang Yilun;Lu Ruiyang;Zhai Zimeng;Huang Yangyang;Wang Fujun;Xin Changchang;Rong Guangyu;Zhao Chen;Jiang Kai;Zhou Xujiao;Zhou Xingtao;Zhu Xinyuan;Hong Jiaxu;Zhang Chuan
核酸治疗药物是下一代药物的重要类别,但在开发组织特异性递送系统方面仍存在挑战。
研究集中于开发新型载体,以提高递送效率、特异性和安全性。
外泌体作为天然细胞外囊泡,被认为是装载siRNA的理想载体,但现有装载策略存在缺陷
DNA拉链介导的膜融合是一种有前途的方法,用于将功能性核酸加载到外泌体中,不破坏外泌体完整性。
研究提出了一种利用DNA拉链将siRNA装载到角膜上皮细胞来源的外泌体的策略,用于治疗干眼病(DED)。
DED是一种多因素慢性眼表疾病,炎症在病理过程中起关键作用。
针对NFKBIZ基因的siRNA被设计并封装在脂质体中,然后与外泌体融合,形成携带siRNA的混合外泌体囊泡(HEV)
HEV构建体保持了外泌体的特征,并能有效递送siRNA至角膜,减少炎症因子分泌,改善干眼症症状。
在干眼症小鼠模型中,携带siRNA的HEV展现出优越的治疗效果。
细胞培养与外泌体分离:使用DMEM培养基培养人类角膜上皮细胞,采用专门培养基培养小鼠初级角膜上皮细胞。通过差速超速离心法从细胞培养上清液中分离外泌体,并使用DLS、NTA和TEM等方法对外泌体进行表征。
siRNA携带脂质体制备:通过乙醇溶解、冻融循环和超声处理制备脂质体,并将针对NFKBIZ基因的siRNA封装其中。使用NanoDrop One和琼脂糖凝胶电泳对siRNA-Lipo进行定量和表征。
siRNA-HEV的制备与表征:利用DNA夹膜介导的膜融合技术将装载siRNA的脂质体与角膜上皮细胞来源的外泌体融合,制备混合外泌体囊泡(siRNA-HEV)。通过共聚焦激光扫描显微镜(CLSM)和荧光分光光度计评估膜融合效率。
基因表达与蛋白质分析:通过实时定量聚合酶链反应(qPCR)和蛋白质印迹分析评估NFKBIZ基因的敲低效率和相关蛋白的表达水平。
ELISA分析:使用ELISA试剂盒检测细胞培养上清液中的炎症因子水平。
小鼠实验:在C57BL/6J小鼠中建立干眼症模型,并通过苏木精和伊红染色、Periodic Acid-Schiff染色以及RNA-Seq等技术评估治疗效果和机制。
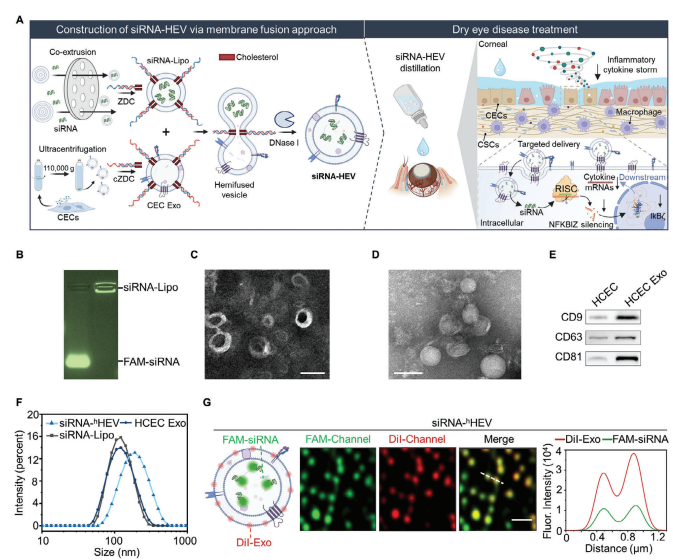
A) 图1A展示了利用DNA拉链介导的膜融合技术将抗NFKBIZ siRNA加载到混合外泌体载体(HEV)中,用于治疗干眼病(DED)的策略。该策略涉及角膜上皮细胞(CECs)、巨噬细胞和角膜基质细胞(CSCs)。
B) 图1B通过1%琼脂糖凝胶电泳展示了FAM标记的siRNA在脂质体(siRNA-Lipo)中的封装情况。
C) 图1C展示了siRNA-Lipo的负染透射电子显微镜图像,用于观察其形态和大小。
D) 图1D展示了来自人类角膜上皮细胞(HCECs)并通过差速超速离心纯化的外泌体的负染透射电子显微镜图像。
E) 图1E通过Western blot分析确认了HCEC来源的外泌体表面存在CD9、CD63和CD81这三种特异性蛋白。
F) 图1F展示了通过动态光散射分析测定HCEC Exo、siRNA-Lipo和siRNA-hHEV的水动力尺寸。
G) 图1G展示了染料标记的siRNA-hHEV的共聚焦激光扫描显微镜图像,其中HCEC来源的外泌体用DiI(红色通道)标记,siRNA用FAM(绿色通道)标记,显示了在膜融合之前两种标记的分布情况。
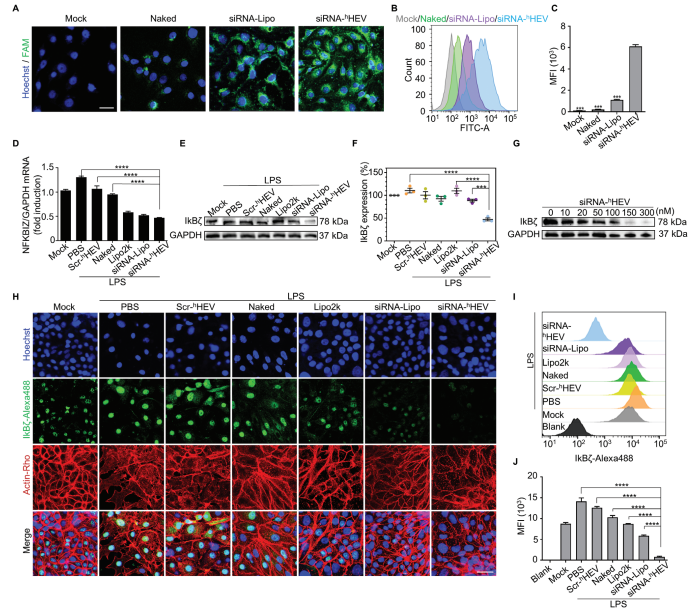
A-C) 图2A-C展示了人类角膜上皮细胞(HCECs)经过siRNA-hHEV、siRNA-Lipo和裸siRNA处理6小时后的共聚焦激光扫描显微镜(CLSM)图像、流式细胞术轮廓及其对应的平均荧光强度。这些实验使用了FAM标记的siRNA来追踪。
D) 图2D展示了在脂多糖(LPS)刺激12小时后,不同处理条件下HCECs中NFKBIZ mRNA表达量的定量聚合酶链反应(qPCR)分析。
E,F) 图2E,F通过Western blot分析检测了Mock和HCECs在LPS刺激后,经过不同处理(包括PBS、Scr-hHEV、Naked、siRNA-Lipo和siRNA-hHEV)6小时的IkB𝜁蛋白表达情况,并显示了三次重复实验的结果。
G) 图2G展示了不同浓度的siRNA-hHEV在LPS刺激后处理HCECs 6小时的IkB𝜁蛋白表达。
H) 图2H通过CLSM图像展示了LPS刺激后,Mock和用不同配方处理的HCECs中IkB𝜁的免疫荧光染色情况。
I,J) 图2I,J通过流式细胞术分析检测了Mock和用不同配方处理的HCECs中IkB𝜁的免疫荧光染色,并展示了流式细胞术测定的平均免疫荧光强度。
所有数据和误差棒均表示三个独立重复实验的平均值±标准误,并使用单因素方差分析法确定p值。统计显著性用不同星号表示:*p < 0.05,p < 0.01, *p < 0.001,****p < 0.0001。
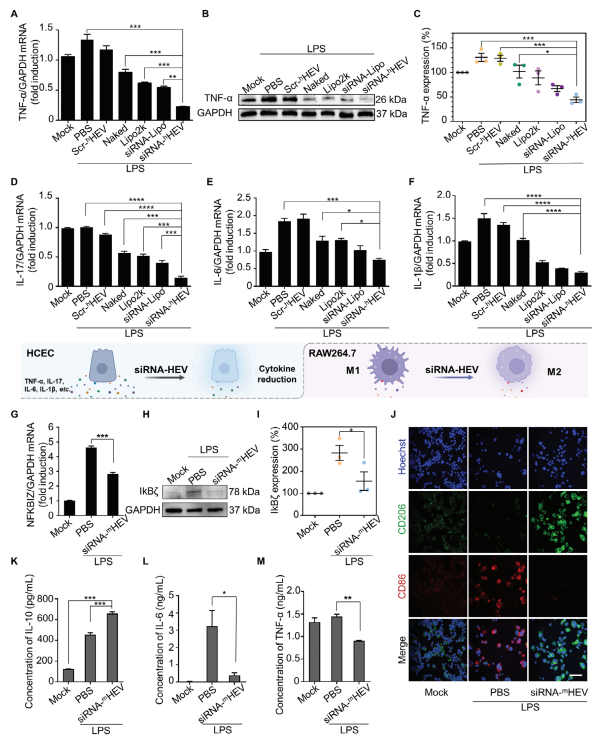
A) 图3A展示了在LPS刺激后6小时,不同配方处理的HCECs中TNF-𝛼 mRNA表达的qPCR分析。
B,C) 图3B,C通过Western blot和统计分析展示了在LPS刺激后,不同配方处理的HCECs中TNF-𝛼蛋白的表达情况。
D-F) 图3D-F展示了在LPS刺激后,不同配方处理的HCECs中IL-17、IL-6和IL-1β mRNA的表达。
G-I) 图3G-I展示了在LPS刺激后6小时,未经处理的RAW264.7细胞和用PBS和siRNA-mHEV处理的RAW264.7细胞中NFKBIZ mRNA和IkB𝜁蛋白的表达。
J) 图3J通过CLSM图像展示了在LPS刺激后,未经处理的RAW264.7细胞和用指示样品处理的RAW264.7细胞中CD206和CD86的免疫荧光染色情况。
K) 图3K展示了在LPS刺激后,未经处理的RAW264.7细胞和用指示样品处理的RAW264.7细胞中IL-10的表达。
L,M) 图3L,M通过ELISA测定展示了在LPS刺激后,未经处理的RAW264.7细胞和用指示样品处理的RAW264.7细胞中IL-6和TNF-𝛼的表达。
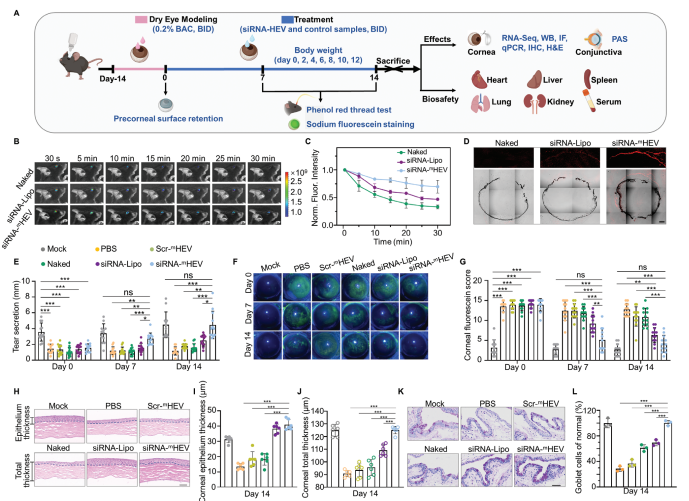
A) 图4A展示了评估siRNA-mHEV在干眼症小鼠模型中治疗效果的流程图。
B) 图4B通过实时体内荧光成像,展示了在麻醉小鼠不同时间点后siRNA-mHEV在泪膜前的保留情况,以及裸露的siRNA和siRNA-Lipo作为对照组。
C) 图4C展示了麻醉小鼠在给药后30分钟内眼睛的荧光强度衰减。
D) 图4D通过冷冻切片的眼球荧光图像,展示了给药后小鼠清醒20分钟时的荧光分布。
E) 图4E展示了使用不同配方治疗的干眼症小鼠以及健康小鼠在不同时间点的泪液分泌量,通过酚红线测试确定。
F) 图4F展示了使用不同配方治疗的干眼症小鼠以及健康小鼠在不同时间点角膜的钠黄素染色情况。
G) 图4G展示了使用指定配方治疗的干眼症小鼠以及健康小鼠在不同时间点角膜的钠黄素染色评分。
H) 图4H展示了治疗14天后的代表性角膜组织学图像。
I) 图4I展示了通过组织学评估的角膜上皮厚度。
J) 图4J展示了通过组织学评估的总角膜厚度。
K) 图4K展示了治疗后结膜PAS染色的代表性图像。
L) 图4L展示了治疗后结膜杯状细胞的丰度,以Mock组为基准进行百分比归一化。
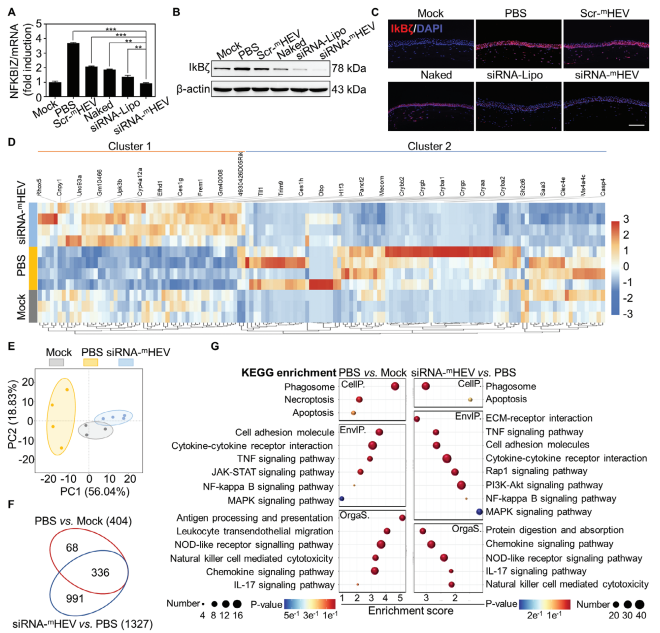
A-C) 图5A-C展示了未处理小鼠(Mock)和使用siRNA-mHEV及对照配方治疗的DED小鼠角膜中NFKBIZ mRNA和IkB𝜁蛋白的表达情况。通过qPCR分析NFKBIZ mRNA表达(A),Western印迹检测IkB𝜁蛋白表达(B),以及角膜横截面的IkB𝜁蛋白免疫荧光染色(C)。
D) 图5D展示了Mock组、PBS处理组和siRNA-mHEV处理组角膜中前100个差异表达基因(DEGs,q < 0.05)的热图。
E) 图5E展示了Mock组、PBS处理组和siRNA-mHEV处理组角膜基因表达的主成分分析(PCA)图。
F) 图5F展示了Mock组、PBS处理组和siRNA-mHEV处理组角膜中显著DEGs(q < 0.05且|FoldChange| > 2)的韦恩图。
G) 图5G展示了显著DEGs的KEGG通路分析,根据KEGG通路一级类别的富集得分对基因谱进行排名,包括细胞过程(CelIP)、环境信息处理(EnvIP)和生物系统(OrgaS)。
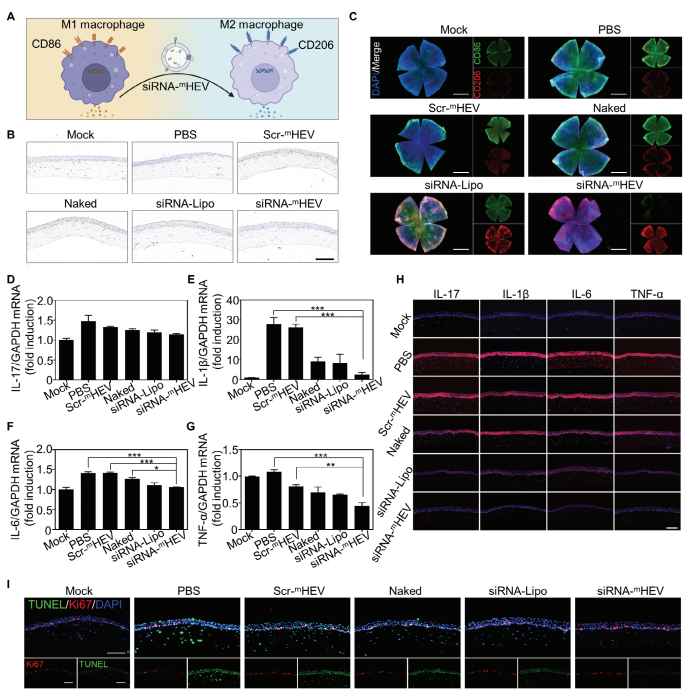
A) 图6A展示了siRNA-mHEV治疗巨噬细胞重编程的示意图,说明siRNA-mHEV如何将角膜过滤的巨噬细胞从M1状态重编程为M2状态。
B) 图6B通过F4/80免疫组化染色展示了Mock和DED小鼠使用指定配方处理后的角膜横截面,用于检测巨噬细胞的存在。
C) 图6C展示了Mock和DED小鼠使用指定配方处理后的整个角膜的CD86和CD206染色,以及细胞核染色,用于区分M1和M2巨噬细胞。
D-G) 图6D-G通过qPCR分析展示了使用指定配方处理后,Mock和DED小鼠角膜中细胞因子mRNA的表达情况,包括IL-17、IL-1β、IL-6和TNF-α。
H) 图6H通过免疫荧光染色展示了Mock和所有治疗组角膜横截面中细胞因子(包括IL-17、IL-1β、IL-6和TNF-α)的表达。
I) 图6I通过CLSM图像展示了Mock和所有治疗组角膜横截面中的TUNEL和Ki67染色,用于检测细胞凋亡和增殖情况。
囊泡融合策略的引入:为解决寡核苷酸治疗的组织特异性递送问题,研究团队引入了囊泡融合策略,将外泌体工程化成HEV结构,作为核酸药物递送的有效载体。
siRNA的封装与递送:治疗性siRNA(针对NFKBIZ基因)被封装在脂质体内,并通过DNA拉链介导的膜融合方法与来自角膜上皮细胞(CECs)的外泌体融合,形成siRNA负载的HEV。
HEV的分子特征与靶向能力:所得的siRNA负载HEV保持了其组成外泌体的分子特征,并利用外泌体的归巢特性,表现出靶向角膜细胞并有效递送siRNA的能力。
炎症微环境的重塑:NFKBIZ基因的敲低显著减少了促炎细胞因子的分泌,重塑了眼部表面的炎症微环境至正常状态。
DED小鼠模型中的治疗效果:在DED小鼠模型中,siRNA负载的HEV实现了优异的治疗效果,证明了其在治疗干眼症方面的潜力。
HEV平台的多功能性:HEV作为一种多功能平台,可以方便地使用来自各种细胞类型的外泌体或装载不同类别的核酸治疗药物。
广泛的疾病治疗潜力:利用外泌体的组织靶向能力和对不同siRNA序列的适应性,HEV构建体在广泛的疾病治疗中具有巨大的潜力
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:超级细菌‘泄密’!高通量技术破解金黄色葡萄球菌的‘毒素运输密码
下一篇:大脑和肌肉老得更快?科学家首次发现‘翻译错误’的器官差异