扫一扫,关注我们
微信公众号
ATCC细胞培养
Kupffer细胞(Kupffer cells,KCs),亦称为肝巨噬细胞,是位于肝脏中的特殊巨噬细胞,同时也是单核吞噬细胞系统的一部分。KCs通过模式识别受体识别外源和内源的危险信号,激活后分化为M1型和M2型。KCs在肝脏的基本功能包括:吞噬清除病原;抗原递呈,启动适应性免疫;促进肝细胞再生等。该试剂盒采用二步灌流法+水浴消化法,结合密度梯度离心法及生物素抗体-链霉亲和素磁珠进行阳选,可快速纯化得到小鼠肝脏Kupffer细胞。使用本试剂盒提取所得的小鼠原代肝脏Kupffer细胞纯度>90.0%,纯化后可直接进行RT-qPCR、Western blot等基本生物学实验,贴壁后可进行药理、病理、毒理学、免疫染色等实验操作。
该试剂盒适用于C57BL/6J、BALB/c等不同品系6周龄以上小鼠的原代肝脏Kupffer细胞提取试剂盒。
本试剂盒规格为10次(以1只6周龄以上小鼠为1次计,约得到5×105-7×105个细胞)
2-8 ℃保存与运输,保质期为参考下表。所有组分开封后,有效期为 6-8 周,建议尽快使用。
表1. 试剂盒组成信息
| 产品名称 | 产品规格 | 储存条件 |
| 小鼠肝脏Kupffer细胞灌注液 Ⅰ | 500 mL | 2-8°C 3 个月 |
| 小鼠肝脏Kupffer细胞灌注液 Ⅱ | 500 mL | 2-8°C 3 个月 |
| 小鼠肝脏Kupffer细胞消化液 | 100 mL | 2-8°C 3 个月 |
| 小鼠肝脏Kupffer细胞消化终止液 | 500 mL | 2-8°C 3 个月 |
| 细胞洗液 | 200 mL | 2-8°C 3 个月 |
| 肝脏Kupffer细胞纯化分离液 | 10 mL | 2-8°C 3 个月 |
| 肝脏Kupffer细胞纯化分离稀释液 | 50 mL | 2-8°C 3 个月 |
| 分选Buffer | 125 mL | 2-8°C 3 个月 |
| 肝脏Kupffer细胞分选试剂 | 44 μL | 2-8°C 6 个月 |
| 肝脏Kupffer细胞分选磁珠 | 210 μL | 2-8°C 6 个月 |
| 肝脏Kupffer细胞专用培养基 | 100 mL | 2-8°C 3 个月 |
实验前准备:将小鼠肝脏Kupffer细胞灌注液Ⅰ、灌注液Ⅱ、消化液置于水浴锅中加热至37℃,备用。实验需自备蠕动泵(若无蠕动泵,选择方案二,但效果不如方案一好)、注射器、静脉留置针、手术器械、75 μm过滤筛、培养皿、离心管若干、磁力架及分选柱(推荐配套购买我司的磁力架:IMC-M03及分选柱:IMC-M04)。
一、肝脏消化
方案一:
1.麻醉并且固定小鼠,酒精喷洒清洗腹部。
2.将蠕动泵的软管冲洗完毕后,软管一端置于预热好的肝脏Kupffer细胞灌注液Ⅰ内,软管另一端与静脉留置针相连接并设置好灌流速度为5 mL/min。
3.剪开小鼠腹腔,沿肝脏上方剪开胸腔隔膜,使上腔静脉暴露,用止血钳夹住上腔静脉。
4.拨开小鼠肠组织,暴露小鼠下腔静脉和肝门静脉,在下腔静脉的位置插入静脉留置针并固定好位置,轻轻拔出针芯,拔出时针管处有回血,此时外套软管留在血管内,启动蠕动泵进行灌注。
5.当见到肝脏充盈,立即剪开门静脉引流,保持至排尽肝脏内血液、肝组织呈现蜡黄色为止。
6.换上肝脏Kupffer细胞灌注液II,将灌流速度改为3 mL/min。并用棉签节律性按压门静脉切口(挤压5-10s左右,间隔30 s-1 min,让肝脏略微充盈,提高消化率),消化肝脏直至用棉签按压肝脏有塌陷感或者部分透明感,条纹样的裂纹。
7.将肝脏沿着膈肌周围整个剪下来置于装有细胞洗液的培养皿中,转移到超净台中清洗一遍。将清洗后的肝脏组织转移至新的装有小鼠肝脏Kupffer细胞消化液的培养皿,用镊子小心去除胆囊和肝脏外的包膜,轻轻撕裂肝组织使肝脏混合细胞散落至培养皿中,未完全分散的部分及肝总管用镊子轻轻拨碎至肝脏Kupffer细胞消化液中。
8.将培养皿中的肝混合细胞及消化液收集于50mL离心管中,37℃水浴消化20分钟。
9.用3-4倍体积的细胞消化终止液终止消化。
方案二:
1.麻醉并且固定小鼠,酒精喷洒清洗腹部。
2.将装有肝脏Kupffer细胞灌注液Ⅰ的注射器的射端(不需要用到针头)与静脉留置针相连接。
3.剪开小鼠腹腔,沿肝脏上方剪开胸腔隔膜,使上腔静脉暴露,用止血钳夹住上腔静脉。
4.拨开小鼠肠组织,暴露小鼠下腔静脉和肝门静脉,在下腔静脉的位置插入静脉留置针并固定好位置,轻轻拔出针芯,拔出时针管处有回血,此时外套软管留在血管内,手推压注射器进行灌注,保持灌流速度为5 mL/min。
5.当见到肝脏充盈,立即剪开门静脉引流,保持至排尽肝脏内血液、肝组织呈现蜡黄色为止。
6.换上肝细胞灌注液II,将灌流速度改为3 mL/min。并用棉签节律性按压门静脉切口(挤压5-10s左右,间隔30 s-1 min,让肝脏充盈,提高消化率),消化肝脏直至用棉签按压肝脏有塌陷感或者部分透明感,条纹样的裂纹。
7.将肝脏沿着膈肌周围整个剪下来置于装有细胞洗液的培养皿中,转移到超净台中清洗一遍。将清洗后的肝脏组织转移至新的装有小鼠肝脏Kupffer细胞消化液的培养皿,用镊子小心去除胆囊和肝脏外的包膜,轻轻撕裂肝组织使肝脏混合细胞散落至培养皿中,未完全分散的部分及肝总管用镊子轻轻拨碎至肝脏Kupffer细胞消化液中。
8.将培养皿中的肝混合细胞收集于50mL离心管中,37℃水浴消化20分钟。
9.用3-4倍体积的细胞消化终止液终止消化。
二、肝脏Kupffer细胞分离纯化
1. 用细胞洗液润洗75 μm筛网,将上述步骤中的培养皿内的细胞浊液用宽头吸头或者巴氏管移至筛网上方过滤。
2. 4℃,300 xg离心10分钟。
3. 弃去上清,用10mL左右细胞洗液进行重悬,离心:4℃,50 xg,5分钟。
4. 吸取大部分上清至新的离心管中(细胞沉淀为肝实质细胞),将细胞悬液进行离心:4℃,50 xg,5分钟。
5. 吸取大部分上清至新的离心管中(细胞沉淀为肝实质细胞),将细胞悬液进行离心:4℃,300 xg,10分钟。
6. 弃去上清,用2 mL细胞洗液重悬沉淀,并配置5 mL 20%肝脏Kupffer细胞纯化分离液(1 mL细胞纯化分离液+4 mL细胞纯化分离稀释液)在15 mL离心管中。轻柔涡旋混匀以后将2 mL细胞悬液铺至肝脏Kupffer细胞纯化分离液上方,离心:1000 xg(2390 rpm),20 min(使用水平转子离心机,加速度减速度均为最低)。
7. 弃去上清,用分选Buffer重悬细胞沉淀,调整细胞密度大约至1×108 cells/mL。
8. 将100 μL细胞悬液(以1×107 个细胞为例)加入1.5 ep管底部,再加入2 μL 分选试剂,混匀后于4℃孵育15 min,期间每隔5 min轻弹离心管管壁使抗体和细胞混合均匀。(以分选1×107个肝非实质细胞中的肝脏Kupffer细胞为例,如果分选更多的细胞,则可按比例增加分选试剂用量,少于1×107个细胞则将细胞悬液体积补至100 μL,加入2 μL分选试剂)
9. 孵育完成后,加入1 mL分选Buffer重悬,离心:500 xg,离心5 min。
10. 用100 μL分选Buffer重悬细胞,加入10 μL 肝脏Kupffer细胞分选磁珠(使用前涡旋振荡重悬磁珠,确保磁珠完全重悬),混匀后4℃孵育10 min,期间每隔5 min轻弹离心管管壁使磁珠和细胞混合均匀(以分选1×107个肝非实质细胞中的肝脏Kupffer细胞为例,如果分选更多的细胞,则可按比例增加肝脏Kupffer细胞分选磁珠的用量,少于1×107个细胞则将细胞悬液体积补至100 μL,加入10 μL 肝脏Kupffer细胞分选磁珠)
11. 孵育完成后,加入1 mL分选Buffer重悬,离心:500 xg,离心5 min(离心期间可将分选柱放入磁场中,加入500 μL或1 mL分选Buffer润洗柱子)
12. 离心完毕后弃去上清,用1 mL分选Buffer重悬细胞,待分选柱内的分选Buffer流尽以后,将重悬好的细胞悬液缓慢加入分选柱中,注意不要产生气泡。
13. 待分选柱中的液体流尽时再次加入1 mL分选Buffer清洗3-4次,流出的液体即为未结合磁珠的细胞。
14. 将分选柱从磁场中移出,置于合适的离心管中,吸取1mL肝脏Kupffer细胞专用培养基加入分选柱,并使用配套的活塞将结合在分选柱上的细胞推出,推出的细胞即为目标细胞(肝脏Kupffer细胞),调整细胞密度后即可种板。
1. 肝脏灌注液在灌注肝脏过程中需保证温度稳定在37℃。
2. 肝脏离体后建议在冰上操作,分散肝脏Kupffer细胞时应避免过度重悬等操作导致细胞机械损伤。
3. 肝脏水浴消化的时间可以根据肝脏灌注情况适当调整,但不建议超过30分钟。
4. 肝脏Kupffer细胞不可使用胰酶进行处理,分离后请直接进行实验。
5. 该分离试剂盒建议与逸漠生物磁力架(IMC-M03)及分选柱(IMC-M04)配套使用。
6. 磁性分选过程中往分选柱内添加细胞悬液或分选Buffer前需使得上一次添加的液体流尽,避免出现分离后细胞纯度低等情况。
7. 小鼠肝脏Kupffer细胞分离试剂盒中的产品含有微生物生长所需的营养成分,请在超净工作台内打开,按照所需要量分装,并且用封口膜封住瓶口,即取即用,以避免污染。

产品规格:1*10^6
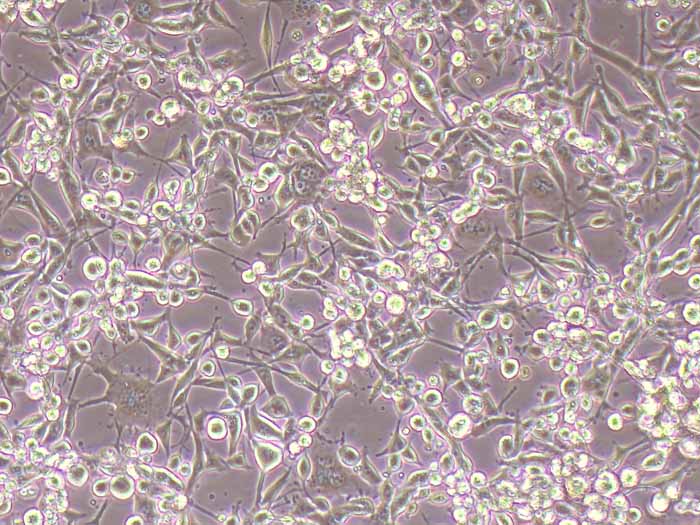
产品规格:1*10^6
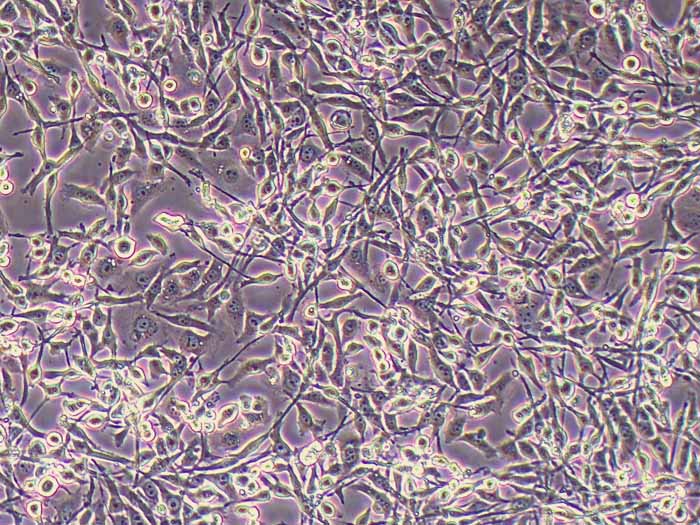
产品规格:1*10^6
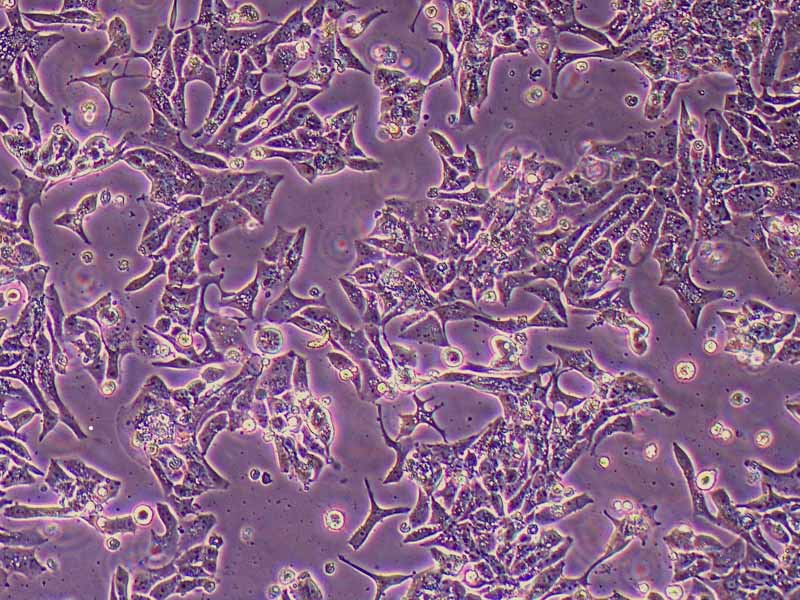
产品规格:1*10^6
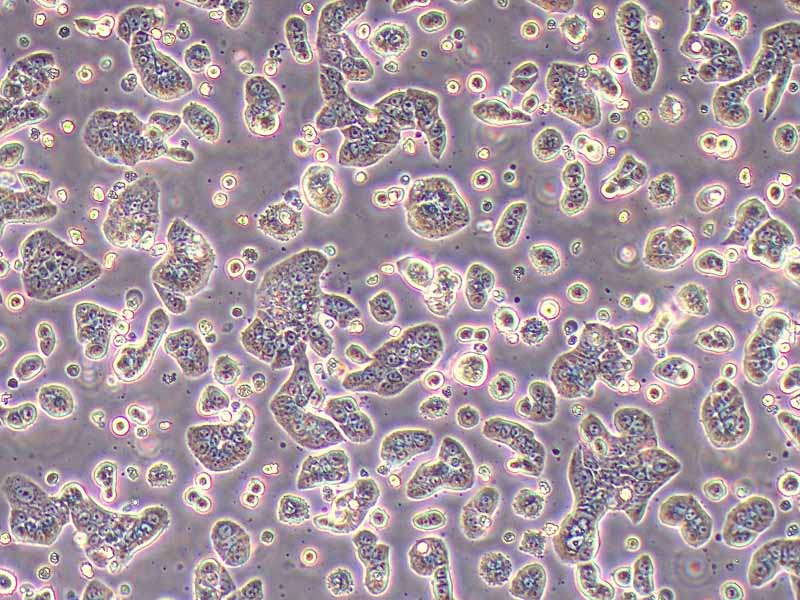
产品规格:1*10^6
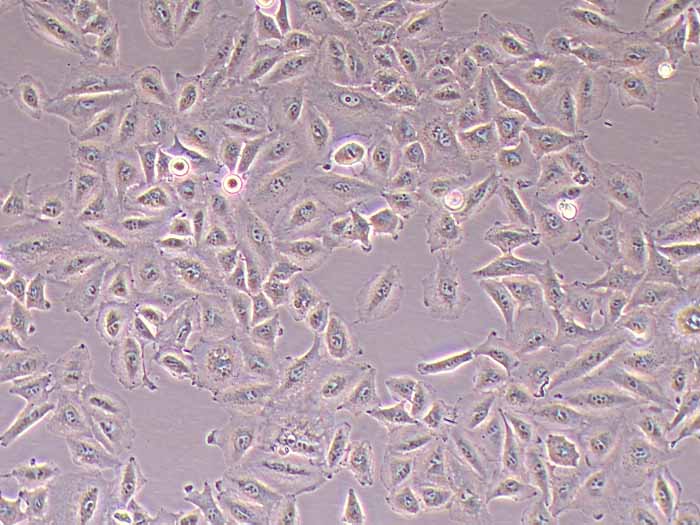
产品规格:1*10^6