扫一扫,关注我们
微信公众号
ATCC细胞培养
脾脏是机体重要的淋巴器官,内含多种重要的免疫细胞,其中小鼠脾脏CD3+ T细胞含量在35%左右,小鼠脾脏CD3+ T细胞分离试剂盒可通过阳性分选法从小鼠脾脏中分离纯化出CD3+ T细胞,纯化后可用于进一步进行培养扩增或者直接进行RT-qPCR、Western blot、流式细胞术等各种免疫学实验。
本试剂盒适用于分离小鼠脾脏中的CD3+ T细胞。
2-8 ℃保存与运输,保质期为参考下表,所有组分开封后,有效期为6个月。
表2. 试剂盒组成信息
| 产品货号 | 产品名称 | 产品规格 | 储存条件 |
| IMP-MK020SA | CD3+T细胞分选抗体 | 20 μL | 2-8°C 6个月 |
| IMP-MK020MA | 40 μL | 2-8°C 6个月 | |
| IMP-MK020LA | 100 μL | 2-8°C 6个月 | |
| IMP-MK020SB | 链霉亲和素纳米磁珠 | 100 μL | 2-8°C 6个月 |
| IMP-MK020MB | 200 μL | 2-8°C 6个月 | |
| IMP-MK020LB | 500 μL | 2-8°C 6个月 |
1.取新鲜小鼠脾脏一只,在 70 μm 细胞筛网上研磨脾脏,以预冷的 PBS 冲洗细胞筛网,收集细胞悬液于50 mL离心管中,500 g,离心5 min(一个小鼠脾脏可取得5-10×107个脾脏细胞)。
2.离心结束,弃上清,加入5 mL红细胞裂解液,室温裂解5 min,再加入20 mL PBS,500 g,离心5 min。
3.离心完成后,弃上清,将脾脏细胞重悬于PBS,细胞悬液用70 μm 细胞筛网过滤后,计数。计数完成后,将脾脏细胞悬液500 g,离心5 min。
4.将细胞重悬于分选Buffer中,调整细胞密度为1×108 cells/mL(分选Buffer为含有2 mM EDTA和2% 胎牛血清(FBS)的PBS或者含有2 mM EDTA和0.5% BSA 的PBS,使用前需预先通过0.22 μm滤膜过滤除菌),调整细胞密度为1×108 cells/mL。
5.取100 uL细胞悬液加入2 μl CD3+ T细胞分选抗体混合均匀,4°C 孵育15 min,期间每隔5 min轻弹管壁使细胞与抗体混合均匀。
6.孵育完成后加入1 mL分选Buffer重悬,500 g,离心5 min,弃去上清,加入100 μL的分选Buffer重悬。
7. 吸取10 μl 链霉素亲和磁珠,加入细胞悬液中,混匀后4°C孵育15 min,期间每隔5 min轻弹管壁使细胞和磁珠混合均匀(此试剂盒说明书为分选1×107个脾脏细胞中的CD3+ T细胞的使用说明,如果分选更多的细胞,则可按比例8抗体和链霉亲和素磁珠的用量,少于1×107个细胞则将细胞悬液体积补至100 μl,加入2 μl抗体和10 μl 链霉亲和素磁珠)。
8.孵育完成后,加入1 ml的分选Buffer重悬,500 g,离心5 min,去除上清,加入500 μL分选Buffer重悬,准备磁性分选。
10.将分选柱放入磁场中,加入500 μL分选Buffer润洗柱子。
11.将重悬好的细胞悬液缓慢加入分选柱中,注意不要产生气泡,待分选柱中的液体流尽时再次加入500 μL分选Buffer清洗两次,流出的液体即为未结合磁珠的细胞。
12.将分选柱从磁场中移出,置于合适的离心管中,吸取1mL分选Buffer加入分选柱,使用配套的活塞将结合在分选柱上的细胞推出,收集推出的细胞即为目标细胞。
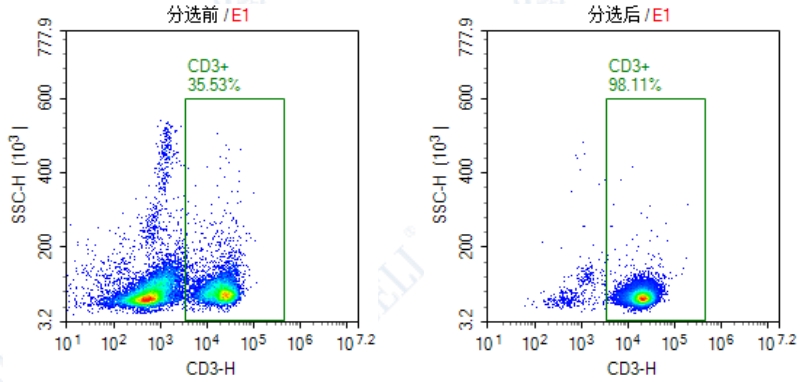
对使用本试剂盒分选前后的小鼠脾脏中的CD3+ T 细胞进行流式细胞分析检测显示,分选前后的CD3+ T细胞纯度分别为35.53%和98.11%。
1.磁珠和抗体混合液使用和保存过程中均应避免冷冻、高速离心等操作。
2.操作过程应在无菌环境下进行,必须保证操作过程中使用的所有容器及所有直接接触细胞液的器具严格无菌。
3.本产品需要与磁力架配套使用。
4.本产品仅供科研使用。

产品规格:1*10^6
产品规格:1*10^6
产品规格:1*10^6
产品规格:1*10^6
产品规格:1*10^6
产品规格:1*10^6