扫一扫,关注我们
微信公众号
ATCC细胞培养
货号:IMP-MK001B
价格:规格:
产品货期:现货
储存与运输:避光运输,2-8℃保存,有效期 3 月
注意:2-8℃中解冻,摇匀后使用,切忌反复冻融,建议分装冻存
不宜长时间放置于室温或4度长期保存
| 产品名称 | 小鼠肝实质灌注液I | |||
| 货号 | IMP-MK001B | |||
| 产品规格 | 500mL | |||
| 货期 | 现货 | |||
| 污染物监测 | 经过严格的内毒素、渗透压、病原体和 pH 检验,确保产品不含病菌、病毒以及支原体等 | |||
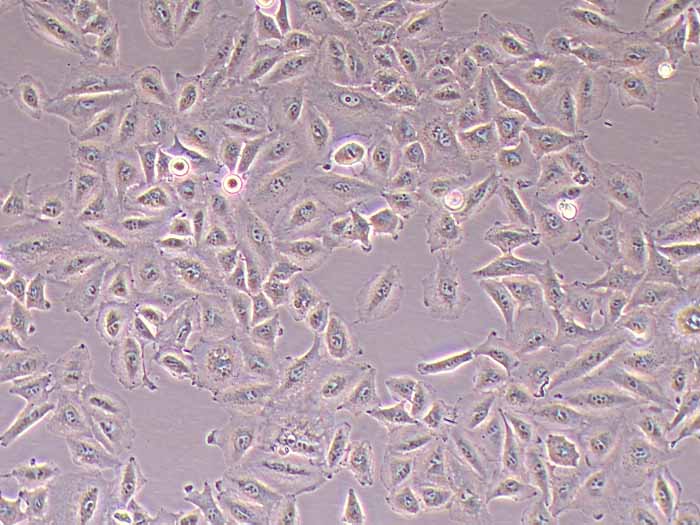
| 产品简介 | 小鼠肝实质灌注液II经过滤除菌,可以直接用于原代小鼠肝实质细胞提取。 | |||
| 产品特性 | 参考官网小鼠肝实质细胞分离试剂盒使用方法使用 | |||
| 保存条件 | 避光运输,2-8℃保存,有效期 3 月 | |||
分离步骤
实验前准备:将小鼠肝实质灌注液Ⅰ、灌注液Ⅱ置于水浴锅中加热至 37℃,备用。实验需自备
注射器、静脉留置针、手术器械、75 μm 过滤筛、离心管若干。
一、肝脏灌注
1.麻醉并且固定小鼠,酒精喷洒清洗腹部。
2.剪开小鼠腹腔,沿肝脏上方剪开胸腔隔膜,使上腔静脉暴露,用止血钳夹住上腔静脉。
3.拨开小鼠肠组织,暴露小鼠下腔静脉和肝门静脉,在下腔静脉的位置插入静脉留置针并固定好
位置,轻轻拔出针芯,拔出时针管处有回血,此时外套软管留在血管内,进行灌注。
4.将装有肝实质灌注液Ⅰ的注射器与静脉留置针相连接,轻轻推动注射器,灌注液 Ⅰ 缓慢灌入,
可见肝脏充盈,此时剪开门静脉引流,保持灌流速度在 5 mL/min 至排尽肝脏内血液、肝组织呈现蜡黄
色为止。
5.换上肝细胞灌注液 Ⅱ,低速(3 mL/min)灌流,并节律性挤压门静脉切口(挤压 5-10s 左右,
间隔 30s-1min,让肝脏充盈,提高消化率),持续消化 5-15min 不等,消化肝脏直至用棉签按压肝脏有
塌陷感或者部分透明感,条纹样的裂纹。
6.将肝脏沿着膈肌周围整个剪下来,转移到一个装有细胞洗液的培养皿中。在超净台中用镊子去
除胆囊和肝脏外的包膜,轻轻抖动组织使肝实质细胞如流沙状流出,未完全分散的部分用镊子轻轻拨
散至细胞洗液中。
二、肝实质分离纯化
1.用细胞洗液润洗 75 μm 筛网,将上述步骤中的培养皿内的细胞浊液用宽头吸头或者巴氏管移
至筛网上方过滤。
2.4℃、50 xg 离心 5 分钟。
3.小心弃去上清(低速离心后,肝实质细胞以松散的方式沉在底部,弃上清时切勿吸力过大或者直
接倾倒上清),加入 15 mL 细胞洗液,用宽头吸头或者巴氏管轻轻重悬沉淀。
4.重复步骤 2,小心弃去上清,加入 5 ml 细胞洗液重悬细胞沉淀。
5.依据细胞活率和数量配置 30%-50%的活细胞纯化液(纯化液浓度越高,得到的肝实质细胞活性
越好,但与此同时,得到的细胞数量会减少,需要依据实验进行取舍,如配置 30% 细胞纯化液配方为:细胞纯化液:分离纯化稀释液 = 3:7)。将细胞悬液小心添加至两倍体积的细胞纯化液面上,细胞悬液
与细胞纯化液间应产生明显分层。
6.400 xg、4 ℃离心 10 分钟(使用水平转子,加速度减速度均为最低)。
离心完毕后离心管底部的沉淀即为纯化后的肝实质细胞,用贴壁培养基重悬。
三、肝实质分离纯化
1.肝实质细胞种板前预先用 Ⅰ 型鼠尾胶原蛋白(以下简称鼠尾胶)铺至培养器皿底部包被 0.5-2 h
(最长不超过 6 h),吸尽鼠尾胶,鼠尾胶可回收使用 1-2 次。
2.使用 1 × PBS 清洗皿底后吸去 PBS。
3.将细胞悬液按照 3 x 105/ml 细胞密度铺至鼠尾胶包被的培养器皿中,转移至细胞培养箱中。
4.4 h 后显微镜下观察,肝实质细胞呈较大圆形、有明显双核结构,将培养器皿内的贴壁培养基更换为维持培养基。
1. 使用本产品时应尽量注意无菌操作,避免污染;
2.不宜长时间放置于室温或4度长期保存;
3.2-8℃中解冻,摇匀后使用,切忌反复冻融,建议分装冻存;
4.由于不同的组织或者细胞对消化液的作用反应不一样,因此操作人员应根据实际情况,确定最佳消化时间;消化时间不宜过长,否则会影响细胞贴壁和生长状况。

产品规格:1*10^6
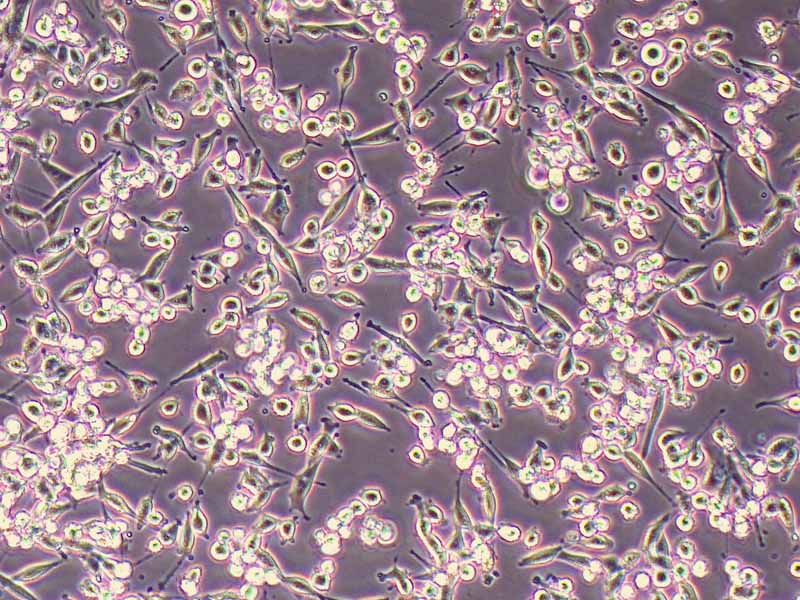
产品规格:1*10^6
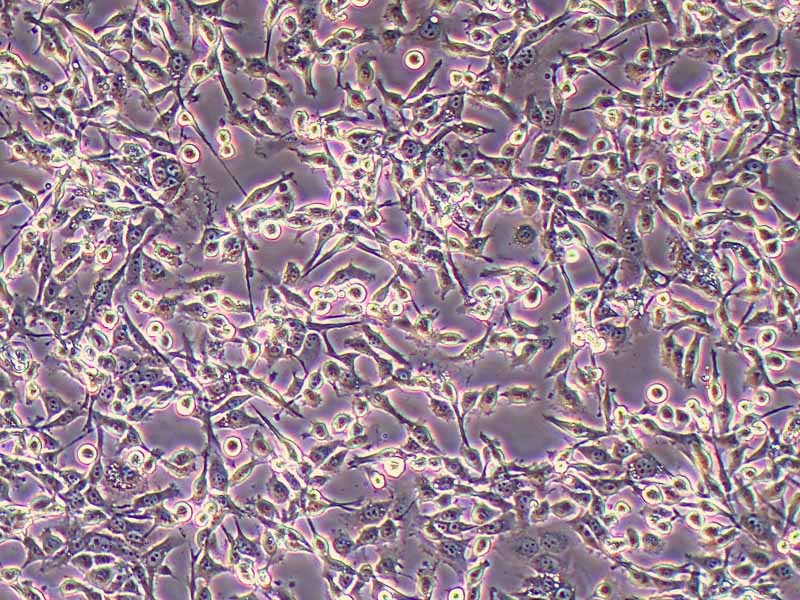
产品规格:1*10^6
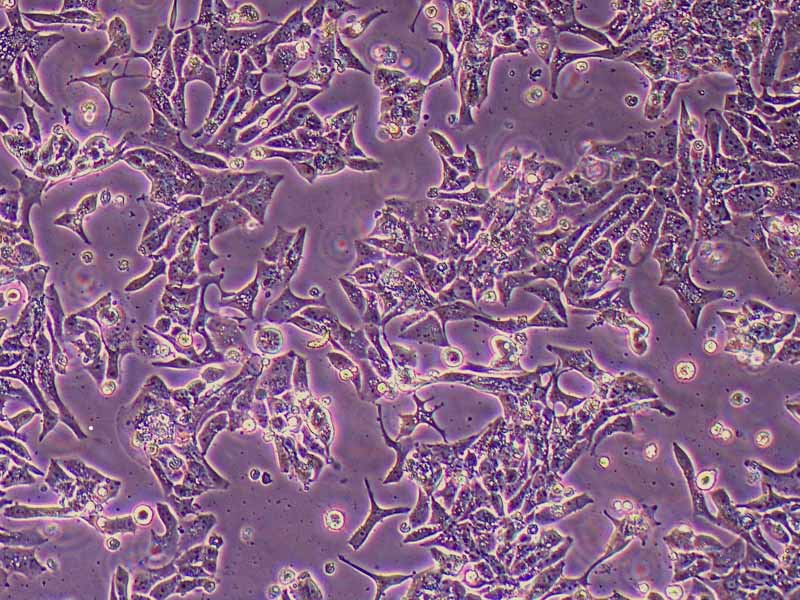
产品规格:1*10^6
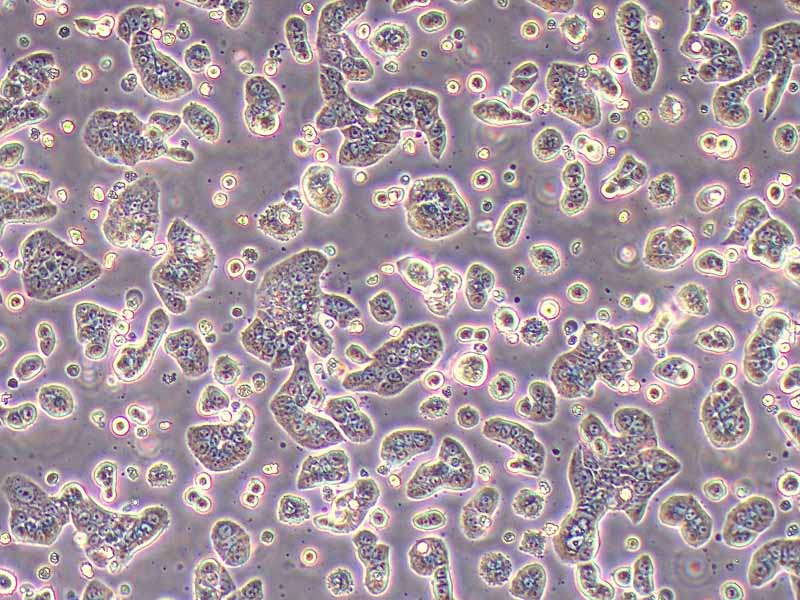
产品规格:1*10^6
产品规格:1*10^6