常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
CHO细胞又称中国仓鼠卵巢细胞(Chinese Hamster Ovary),1957年美国科罗拉多大学Dr. Theodore T. Puck从一成年雌性仓鼠卵巢分离获得,是一种来源于中国仓鼠卵巢的上皮细胞系。
| 中文名称 | 中国仓鼠卵巢细胞 | 英文名称 | Chinese Hamster Ovary;cho |
| 发现人 | Theodore T. Puck | 发现时间 | 1957年 |
| 产地 | 中国 | 细胞形态 | 成纤维细胞样 |
| 组织来源 | 卵巢 | 生长特性 | 贴壁细胞 |
CHO细胞属于成纤维细胞,是一种非分泌型细胞,它本身很少分泌CHO内源蛋白,因此对目标蛋白分离纯化工作十分有利。可形成有活性的二聚体(如白介素2),具有糖基化的功能(如EPO), CHO为表达复杂生物大分子的理想宿主。该细胞存在遗传缺陷,无脯氨酸合成基因,不能将谷氨酸转变为谷氨酸-半醛,培养过程中需在培养基中添加L-脯氨酸才能生长。并且由于该细胞已经霍乱毒素适应,形态学有所改变。最初细胞为贴壁型细胞,经多次传代筛选后,也可悬浮生长。
CHO细胞最早由Puck实验室在1957年分离,通过将0.1g中国仓鼠卵巢组织酶解消化获得。酶解后大部分细胞属于成纤维细胞,在进行超过10个月的体外培养后,细胞并未表现出普通二倍体细胞的Hayflick界限,仍然可以继续分裂生长,但是细胞形态从最初的成纤维细胞转变成近上皮细胞的形态。1958年Puke实验室将此连续传代细胞进行重新克隆后,建立了我们现在所用的CHO细胞最原始细胞系。
这个最原始的CHO细胞系是脯氨酸缺陷型的,必须在培养基中添加额外的脯氨酸以支持其生长,目前所有已知的CHO细胞系均保留了这个特性。这个最原始的CHO细胞系后来流转到不同的实验室和公司,经过不同的培养、驯化、改造和重新克隆后形成了不同种类的CHO细胞系。这些细胞系虽然都是来源于最原始的CHO细胞系,但由于CHO细胞基因组内在的不稳定性及后续不同实验室的筛选培养条件不同,不同CHO细胞系之间的形态、生长、表达、代谢、甚至基因组都有较大差异,下面就几种常用的CHO细胞系进行描述。
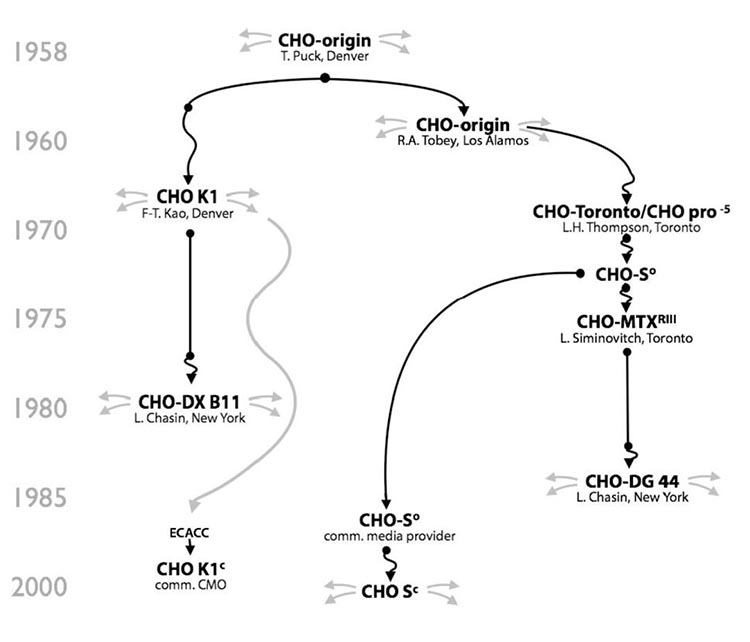
CHO-K1是未经改造的野生型CHO细胞。最初的CHO-K1是在1970年左右,由Puck和Kao的实验室将原始CHO细胞系的一个亚克隆存放于ATCC(CCL-61),并命名。随后源于ATCC CHO-K1的一个亚克隆在1985年被分离,并保存于ECACC(85051005),并被制药公司和CMO公司用作重组蛋白的表达。最原始的CHO-K1细胞是贴壁培养,并需要添加血清,由于血清的批间稳定性问题,及后来病毒安全性问题,无血清悬浮培养成为趋势。其中Lonza公司从ECACC获得CHO-K1驯化到悬浮无血清培养后,建立CHO K1 SV(Lonza,2002)细胞株,并广泛应用于其GS表达平台。Merck(原SAFC)也是从ECACC获得CHO-K1细胞株,并悬浮驯化至化学成分限定培养基中,形成了CHOZN® CHO K1(Merck,2006)细胞株。
基于CHO-K1细胞的表达平台多采用GS(谷氨酰胺合成酶)筛选系统和/或抗生素筛选系统。采用GS筛选系统的平台可在转入目的蛋白基因的同时转入GS基因,在筛选阶段采用不含谷氨酰胺的培养基进行筛选。但由于CHO-K1细胞具有内源的GS基因,因此在筛选时往往需要添加MSX甚至和一定量的抗生素同时筛选,以提高筛选效率。此外,由于内源GS基因的存在,筛选出的高表达克隆往往稳定性较差,需要进行充分的稳定性评估后,方可用于后期的工艺开发及规模化生产。而单独采用抗生素进行筛选的平台,因筛选效率较低,多用于研究阶段。目前多个已经上市的治疗性蛋白是基于CHO-K1细胞进行开发生产的。
基于原始的CHO细胞系,1973年Thompson实验室分离了一株可用于悬浮培养的CHO细胞,并将此细胞命名为CHO-S。虽然都来源于最原始的CHO细胞系,但从细胞历史分枝上看,CHO-S和CHO-K1分属于不同的代系。此细胞系在1980年代后期提供给当时的Gibco公司,后者将此细胞驯化至CD CHO培养基中,建库并以CHO-S名称进行推广。因其能在无血清培养基中悬浮生长,并支持高密度培养,在早期常被用作瞬时表达宿主细胞。此后,相应的GMP细胞库被建立,并支持商业化授权开发。
CHO-DXB11(又名DUK-XB11)是由哥伦比亚大学的Urlaub和Chasin在1970-80年代通过伽马射线诱变的方法获得。CHO-DXB11细胞的双等位基因中,一个DHFR基因被敲除,另一个DHFR基因仅包含一个错义突变(T137R),这使得此细胞不能有效还原叶酸而合成次黄嘌呤(H)和胸苷(T)。在表达外源重组蛋白时,将外源的DHFR基因和目标蛋白基因同时转染细胞,并通过缺乏HT的培养基进行筛选。由于DHFR基因可以通过重组重排进行基因扩增,在适当的MTX压力下,可以通过DHFR基因的扩增同时获得目标蛋白基因的扩增,从而获得更高表达的稳定表达细胞株。在早期CHO细胞培养时通常需要加入血清,因此在当时的细胞筛选protocol里面经常会看到用透析血清来避免引入HT或其它核酸代谢底物。此外需要指出的是,CHO细胞平台上第一个被批准上市的tPA就是采用DXB11做为宿主细胞,并且此宿主细胞被Genentech用于后续的多个商业化产品生产。
由于DXB11细胞中仅有一个等位基因被敲除,在长期传代过程中,会发生低几率的突变使宿主细胞重新恢复DHFR基因活性,造成筛选压力的下降甚至导致重组蛋白表达量的下降。因此,获得一个双等位DHFR基因完全敲除的宿主细胞成为一个需求。Chasin实验室先后通过化学诱变和伽马射线诱变,最终在1983年筛选出了双等位DHFR基因敲除的CHO宿主细胞,并命名为CHO-DG44。虽然和DXB11都属于DHFR基因缺陷型,但从谱系分枝来看,DG44和CHO-S更为接近。因为DG44细胞完全缺失了DHFR基因的活性,并且可以无血清悬浮培养,使得筛选和加压过程变得更加有效。目前多家公司及CDMO企业采用此细胞做为平台进行治疗性蛋白的开发,已经有多个产品进入临床及上市阶段。
Lonza在其CHOK1SV细胞的基础上,与Cellectis 合作并利用后者的Meganucleases技术将CHOK1SV细胞中GS的双等位基因完全敲除,于2012年推出了CHOK1SV GS-KO细胞株。由于内源性的GS基因被完全敲除,大大提高了筛选效率,缩短了稳定细胞株的开发周期(相比CHOK1SV系统缩短了6周),同时提升了最终克隆的稳定性。基于GS-KO细胞的GS Xceed表达平台除包括宿主细胞株外,还包括相应的质粒及V8培养基系统。GS Xceed已经在全球用于多个产品的开发,并向全球授权(Lonza一代CHOK1SV不给中国授权)。但由于V8培养基系统相对复杂,多数CHOK1SV/GS-KO客户并未采用其培养基系统。
Merck(原SAFC)于2006年通过ECACC获得CHO-K1细胞株,并将其驯化至化学成分限定培养基CD Fusion中,然后进行亚克隆建立CHOZN CHO K1细胞系。在此细胞系基础上,通过ZFN(锌指核酸酶)技术敲除GS双等位基因,获得GS缺陷型细胞株CHOZN GS,并于2012年推向市场。整个平台除细胞株外,还包括质粒、克隆构建阶段用的培养基及流加工艺平台培养基。通过平台化的培养工艺进行细胞筛选,可将稳定细胞株构建及上游工艺开发周期缩减到18个星期。目前以CHOZN GS做为宿主细胞的多个项目已经在全球多个国家推进到临床实验阶段。
除了上述在工业界应用较多的细胞系外 ,还有其他一些CHO细胞系也在应用。
如在欧洲应用比较多的Selexis公司SURE CHO-M细胞株,其源于ECACC CHO-K1细胞系,并经驯化后获得,Selexis表达平台同时运用MARs元件来提升筛选效率和目标蛋白表达量,运用CHO-M的多个项目已经推进到临床实验阶段并有一个分子获得批准上市。
Horizon的HD-BIOP1(GS Null CHO-K1)也是源于ECACC CHO-K1细胞系,通过rAAV技术将双等位GS基因敲除,获得GS缺陷型细胞,但由于基因编辑实验过程中部分实验关键材料记录不全而引起监管机构的担心,Horizon试图通过全基因组测序来消除监管机构的担心,但由于基因组数据过于庞大以及现在对整个基因组数据的解读尚需时日,目前为止尚未在欧美国家获得临床实验批准。
CHO细胞虽可像微生物细胞一样,在人工控制条件的生物反应器中进行大规模培养,但其细胞结构和培养特性与微生物细胞相比,有显著差别;动物细胞比微生 物细胞大得多,无细胞壁,机械强度低,对剪切力敏感,适应环境能力差;倍增时间长,生长缓慢,易受微生物污染,培养时须用抗生素;培养过程需氧量少;培养过程中细胞相互粘连以集群形式存在,原代培养细胞一般繁殖50代即退化死亡;代谢产物具有生物活性,生产成本高,但附加值也高
具有不死性,可传百代以上,是生物工程广泛使用的细胞系
属于成纤维细胞,可贴壁培养,经多次传代筛选后也可悬浮培养
一种非分泌细胞,本身很少分泌内源蛋白,因此对目标蛋白分离纯化十分有利
形成有活性二聚体,具有糖基化功能,是表达复杂生物大分子的理想宿
可在人工控制条件的生物反应器中大规模培养
比微生物细胞更大,无细胞壁,机械强度较低,对剪切力敏感,环境适应能力差
配增时间长,生长缓慢,易受微生物污染
培养过程中细胞相互粘连以集群形式存在
培养过程需氧量少,代谢产物具有生物活性,生产成本
具有准确的转录后修饰功能,表达的糖基化药物蛋白分子在分子结构.理化特性和生物学功能更接近天然蛋白分子
具有产物胞外分越功能,便于下游产物分离纯化
具有重组基因的高效扩增和表达能力
具有贴壁生长特性,可以进行悬浮培养,具有较高的表达能
构建重组CHO细胞生产效率低,产物浓度也低
某些糖基化表达产物不稳定,不方便纯化
重组细胞上游构建与下游分离纯化脱节,主要表现在,上游高效表达与下游有效提取之间的矛盾
重组细胞培养费用昂贵,自动化水平低
随着以CHO细胞为主的动物细胞表达系统日益完善,动物细胞将成为基因工程药物的主要宿主细胞.研发人员将对以下问题进行主要研究
1.提高表达水平,如发展些新的强启动 子,装配适合于高效表达的必要元件
2.在提高表达的同时,注重下游分离纯化,如改变中的个别序列,使表达产物在不影响生物活性的前提下携带有利于分离纯化的基团
3.细胞培养成本的控制,高密度高产量和培养设备的大型化自动化和精窍化
4.分离纯化的低成本和高活性回收率
1. G. Urlaub, E. Kas, A.M. Carothers, L.A. Chasin (1983), “Deletion of the diploid dihydrofolate reductase locus from cultured mammalian cells”, Cell, 33, pp. 405-412
2. Hauser, H. and R. Wagner (2014). Animal Cell Biotechnology: In Biologics Production
3. Fischer, S., R. Handrick and K. Otte (2015). 'The art of CHO cell engineering: A comprehensive retrospect and future perspectives.' Biotechnol Adv 33(8): 1878-1896.
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000