常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2026-01-09 09:00:07 细胞资源库平台 访问量:3
肝癌是全球癌症相关死亡的第三大原因,其中肝细胞癌(HCC)占 75%-85%,其高度异质性(包括基因变异、肿瘤微环境差异)导致传统治疗(手术、化疗、靶向药)响应率低,预后差。传统研究模型存在显著局限:2D 细胞系无法模拟肿瘤三维结构和微环境;患者来源异种移植(PDX)模型建立耗时、成功率低(全球 < 20%),且人类基质细胞易被小鼠细胞替代,丢失肿瘤异质性;动物模型与人类生理差异大,药物筛选准确性不足。肝癌类器官作为患者来源的三维模型,能保留原发肿瘤的组织学特征、遗传异质性和药物响应特性,为研究肿瘤生物学、药物敏感性及精准治疗提供理想平台。本综述系统阐述肝癌类器官的构建、在精准医学中的应用及技术进展。
来自广西中医药大学、深圳大学第一附属医院的团队在《iLIVER》期刊发表了题为The application of liver cancer organoids in tumour precision medicine: A comprehensive review的综述。
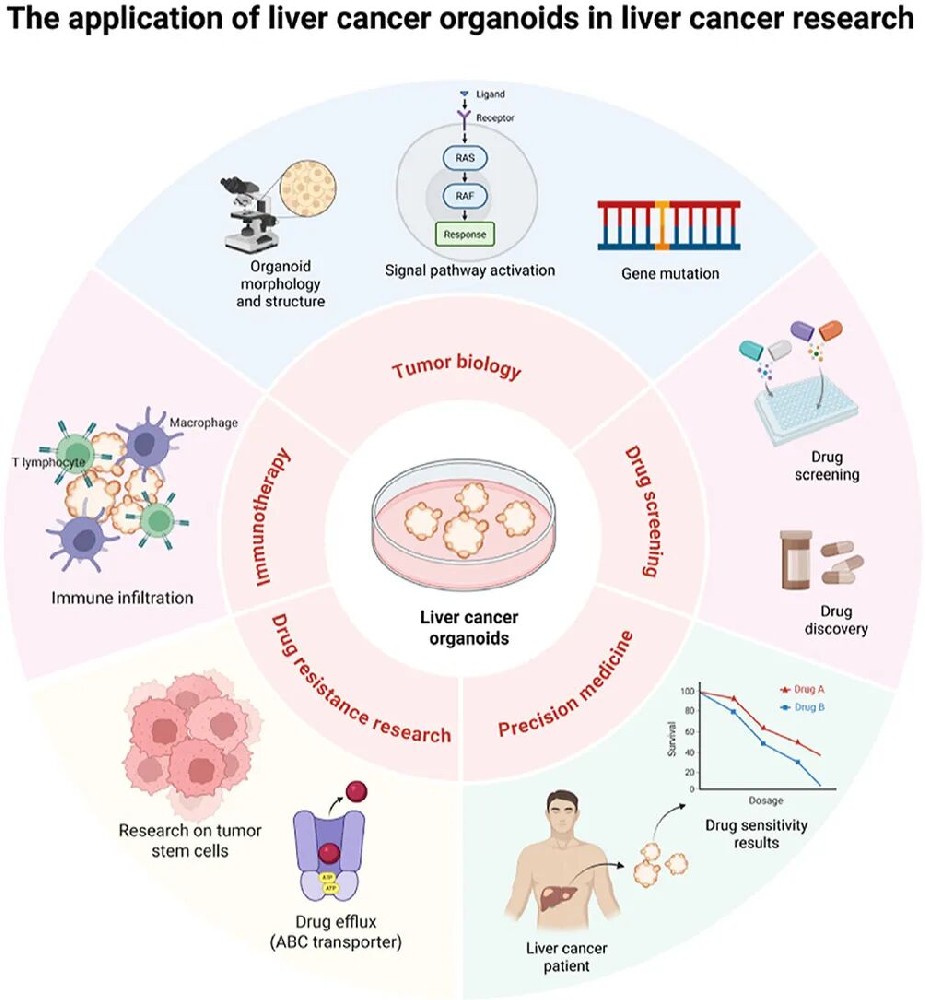
细胞来源:包括成人肝干细胞、诱导多能干细胞(iPSCs)、患者肿瘤组织(手术或穿刺样本),其中患者来源类器官(PDOs)保留 TP53、KRAS 等驱动突变及组织学特征;
培养条件:使用含生长因子(Wnt3a、FGF10)和小分子(CHIR99021、Y-27632)的培养基,通过去除 R-spondin-1 等因子抑制正常肝细胞生长,富集肿瘤细胞;基质采用 Matrigel 或合成水凝胶(如 PEG 衍生物),调控力学性能;
验证方法:通过免疫组化(HCC 标志物 TTF-1、CK19)和靶向测序确认与原发肿瘤的一致性。
药物筛选:利用类器官对 129 种 FDA 批准药物进行高通量筛选,发现仅 13 种对多数类器官有效(杀伤率 > 90%),支持个性化用药选择;
耐药机制研究:发现高氧信号通过上调 NEAT1 激活 JAK-STAT 通路,增加 CD44 + 亚群导致耐药;mTOR 通路激活与索拉非尼获得性耐药相关,抑制该通路可逆转耐药;
免疫治疗评估:类器官与外周血单个核细胞(PBMCs)共培养模型,可预测免疫检查点抑制剂(如阿替利珠单抗)响应,准确率优于传统模型;
多组学分析:结合基因组、转录组和蛋白质组,鉴定出葡萄糖 - 6 - 磷酸脱氢酶为潜在治疗靶点,并发现仑伐替尼与 mTOR 抑制剂替西罗莫司联合具有协同抑癌作用。
微流控芯片:自动化培养平台(如含 200 个培养腔的芯片)实现动态调节营养和药物浓度,支持实时成像监测,适用于高通量药物筛选;
3D 生物打印:采用体积生物打印技术,20 秒内构建厘米级复杂结构,嵌入肝类器官形成可灌注血管网络,提升长期培养稳定性;
基因编辑:CRISPR/Cas9 技术构建特定突变模型(如 TP53 R249S 突变),研究基因突变在肝癌发生中的作用。
微环境模拟不足:通过共培养系统(如 CAFs - 类器官 - PBMCs 模型)引入免疫细胞和基质细胞,重现肿瘤 - 免疫互作;
长期保存困难:优化冷冻保护剂(如甲基纤维素 + DMSO+Y27632)减少冰晶损伤,维持类器官结构完整性;
器官间协同缺失:构建肝 - 胰 - 肠多器官类器官芯片,模拟体内器官相互作用;
标准化问题:建立统一培养协议和质量评估标准,推动跨实验室结果可比性。
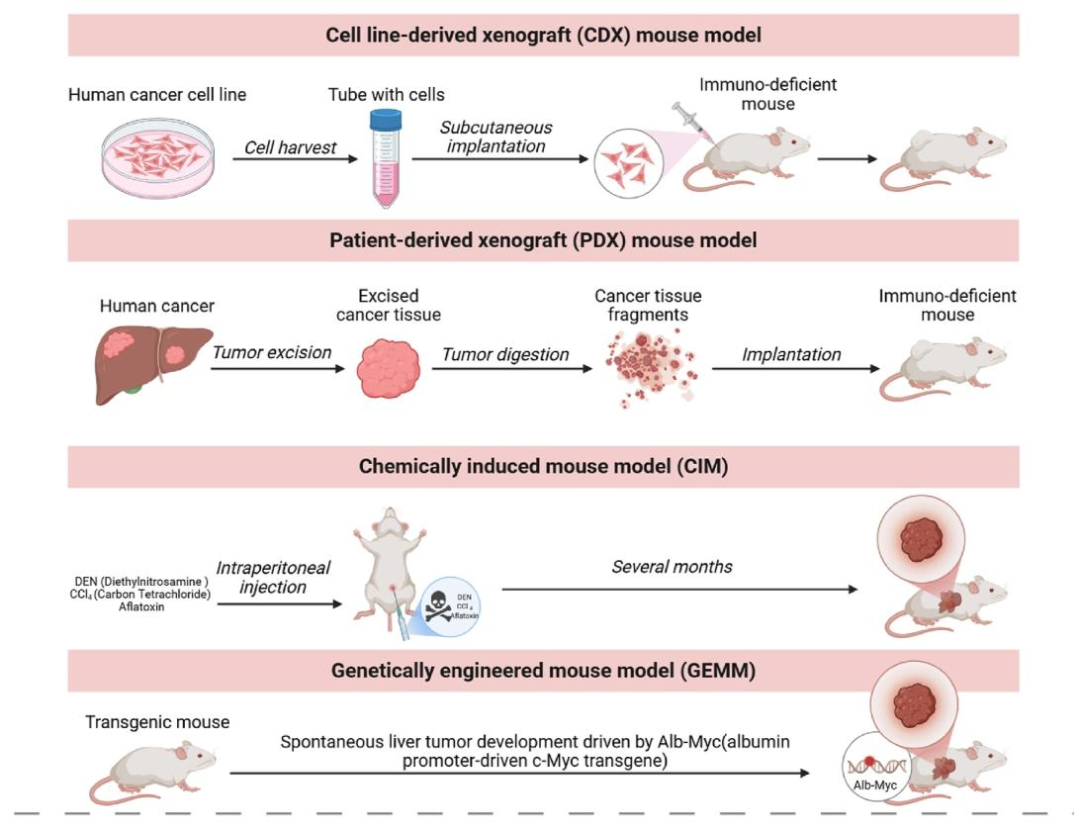
图 1:肝癌小鼠模型的构建
内容:展示四种常用模型 —— 细胞系来源异种移植(CDX)、患者来源异种移植(PDX)、化学诱导模型(CIM)、基因工程小鼠模型(GEMM)的构建流程,对比其操作难度和适用场景,凸显 PDX 模型保留肿瘤特征但成功率低的特点。

图 2:不同研究模型的优劣势对比
内容:表格形式对比 2D 细胞培养(易操作但缺乏微环境)、动物模型(接近体内但物种差异大)、类器官(保留异质性但成本高)、类器官芯片(多器官互作模拟但技术要求高)的优缺点,强调类器官在精准医学中的综合优势。
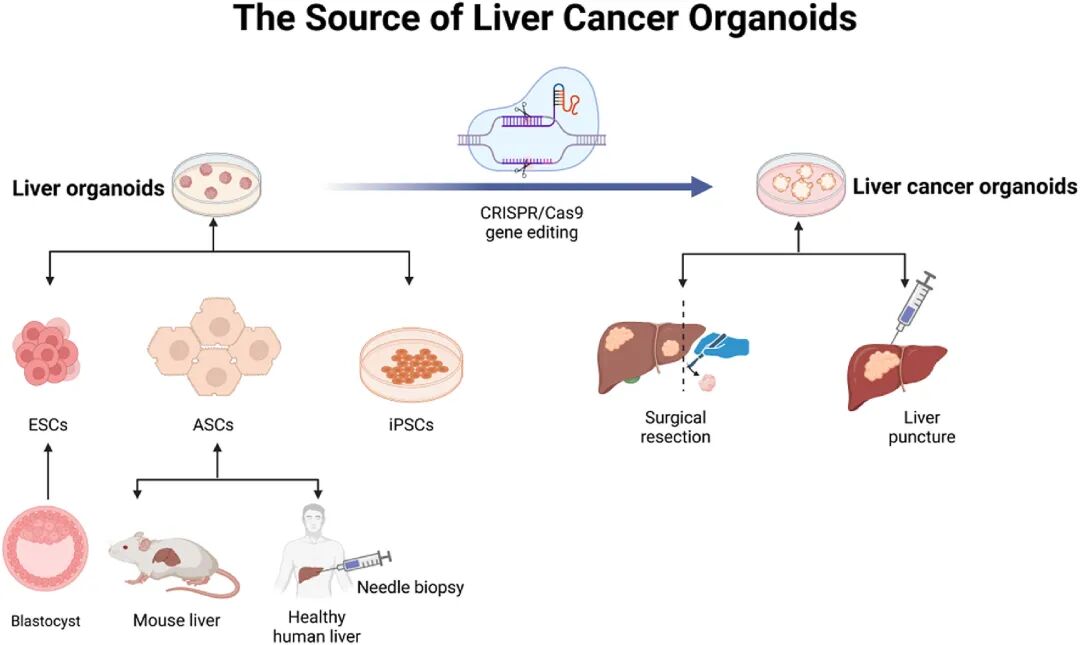
图 3:肝癌类器官的来源
内容:展示正常肝类器官可源自胚胎干细胞(ESCs)、成体干细胞(ASCs)、iPSCs;肝癌类器官可通过患者肿瘤组织(手术 / 穿刺样本)或基因编辑(如 CRISPR 改造正常类器官)获得,体现构建路径的多样性。
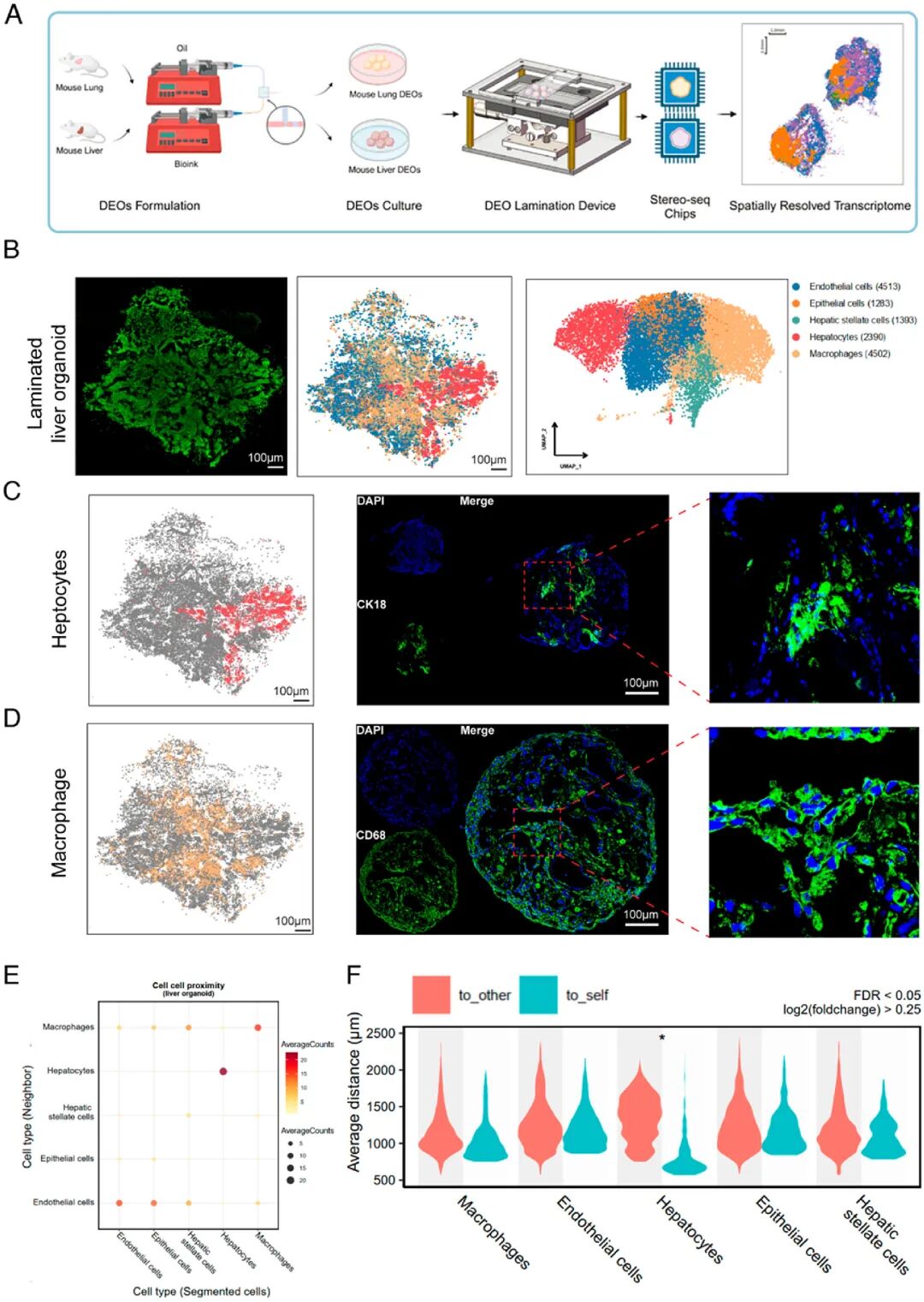
图 4:基于层压技术的类器官空间分辨转录组技术(LOSRT)
内容:展示一种自动化、集成化的空间转录组分析方法,适用于标准化快速表征原发组织来源的类器官。其中,(A)为 LOSRT 流程示意图:工程化类器官(DEOs)通过重量压缩在装置中层压,随后转移至 BGI Stereo-seq 芯片进行空间转录组分析;(B)为层压肝类器官的单细胞 DNA 成像、空间分辨细胞类型注释及分类,蓝色标注内皮细胞、橙色标注上皮细胞、绿色标注肝星状细胞、红色标注肝细胞、黄色标注巨噬细胞;(C)为 CK18 标记的肝细胞的空间分布,通过类器官冷冻切片的 CK18 免疫荧光染色验证;(D)为 CD68 标记的巨噬细胞的空间分布,通过类器官冷冻切片的 CD68 免疫荧光染色验证;(E)为层压肝类器官空间模式的点阵图;(F)为小提琴图,显示层压肝类器官中不同细胞类型的空间距离,Wilcoxon 秩检验显示肝细胞 “与其他细胞” 和 “与自身” 组间存在显著差异(p<0.05)。该技术保留类器官内几乎所有细胞的组成及区域分布,实现单细胞水平的空间注释,为肝细胞互作研究提供新视角。
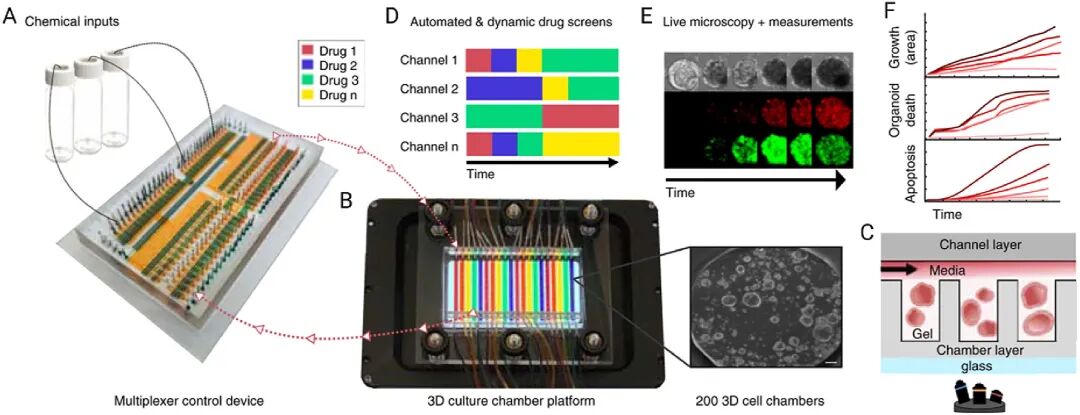
图 5:自动化微流控 3D 培养平台
内容:展示含可编程膜阀的微流控芯片(30 个化学输入通道)与 200 腔室 3D 培养装置的组合,实现动态药物刺激和实时成像,支持数百个类器官的并行培养与分析。
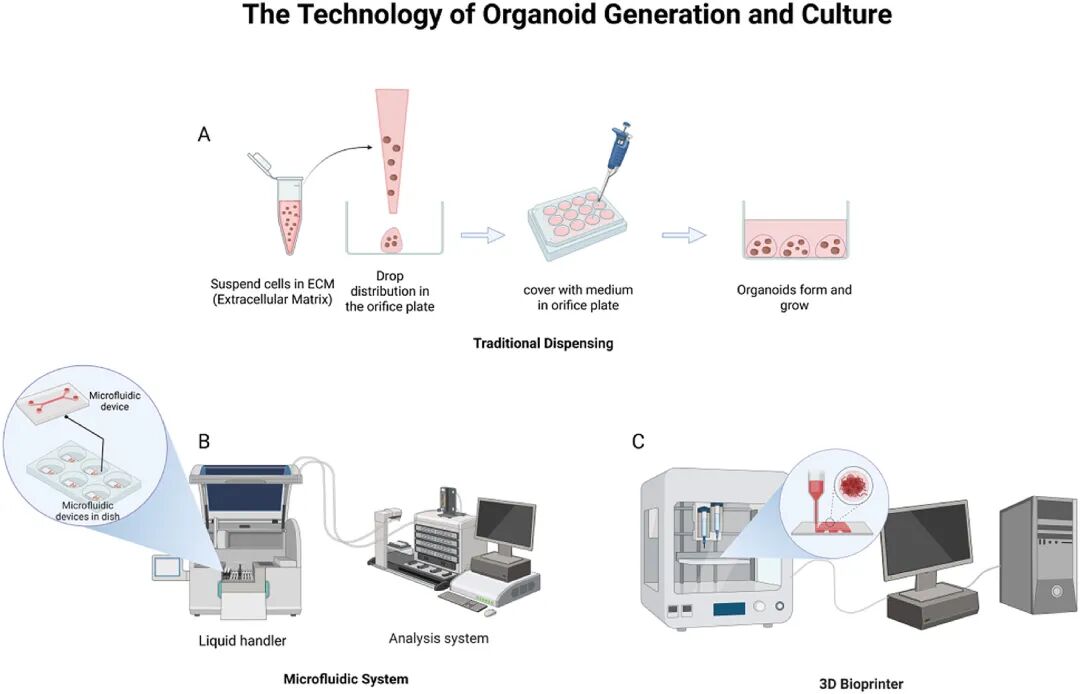
图 6:类器官构建技术对比
内容:对比传统手动接种(效率低、均一性差)与微流控系统、3D 生物打印技术(高效、结构可控),显示生物工程技术解决了传统方法的局限,提升类器官质量。
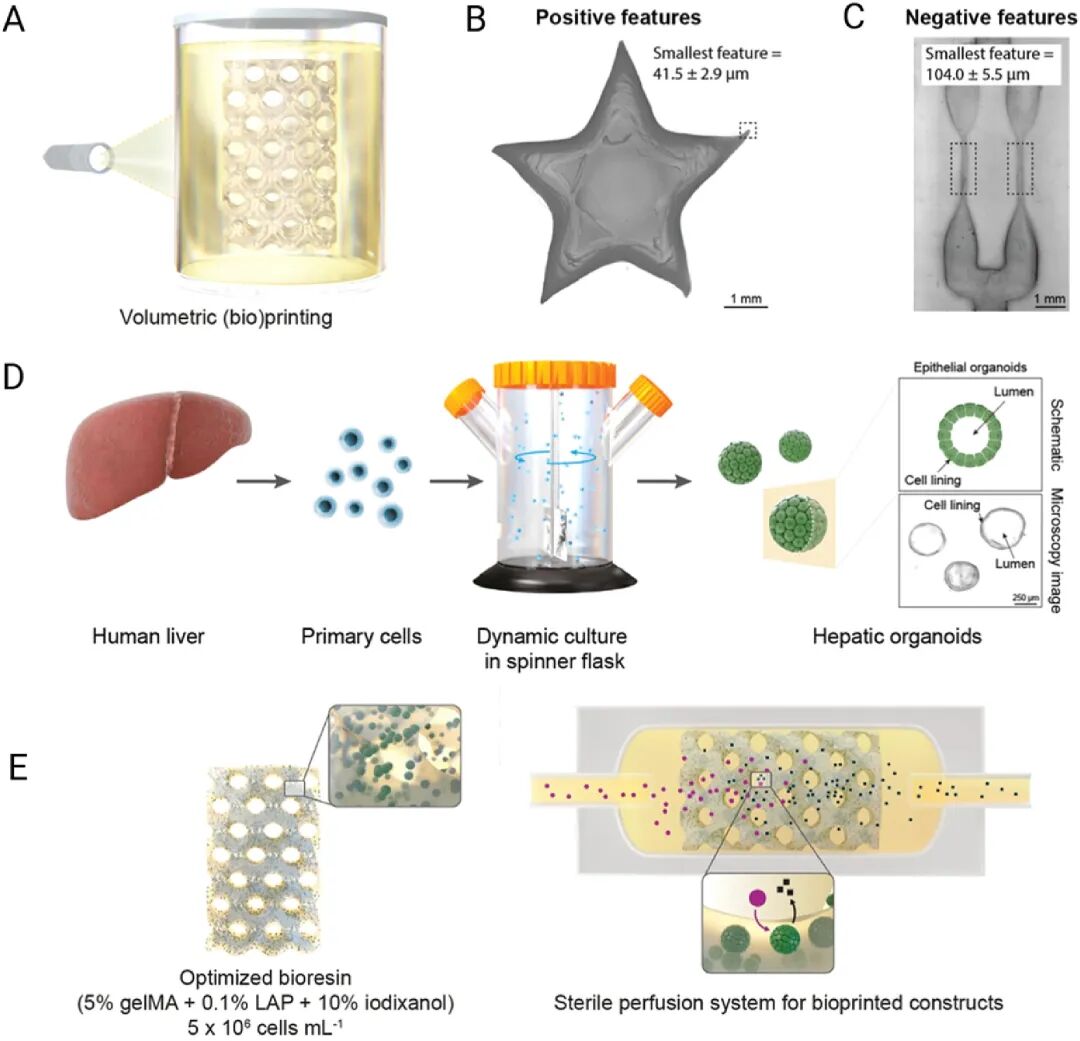
图 7:高分辨率体积打印流程与研究设计概述
内容:展示体积生物打印技术的应用,该技术无需逐层打印,通过光驱动快速(20 秒内)构建复杂结构。其中,(A)为体积打印流程示意图;(B、C)显示使用 5% gelMA + 0.1% LAP 生物树脂实现的高分辨率打印效果,阳性特征分辨率达 41.5±2.9μm,阴性特征(可灌注结构)达 104.0±5.5μm;(D)为肝类器官培养系统流程图,从人类肝活检样本分离细胞,经旋转 flask 动态培养获得高产量的中空上皮类器官结构;(E)展示在动态灌注条件下培养的复杂填充类器官生物工厂,可将灌注化合物(紫色圆圈)分解为代谢物(黑色方块),体现该技术在模拟肝脏代谢功能中的潜力。
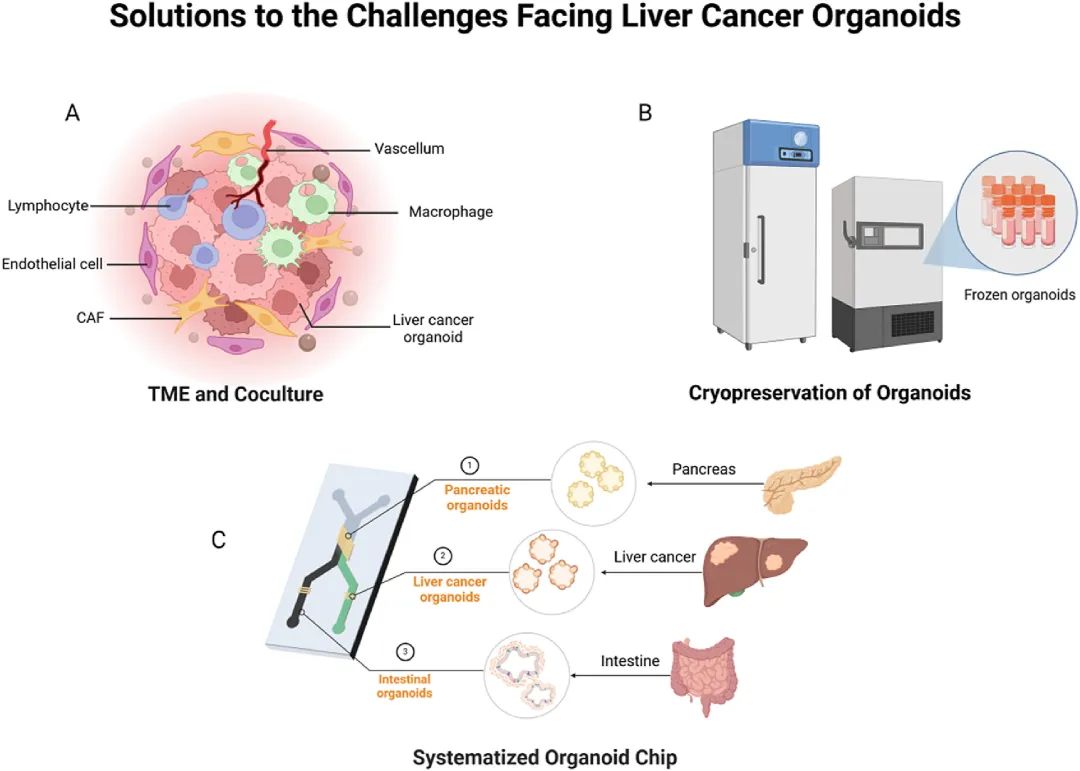
图 8:肝癌类器官的挑战与解决方案
内容:图示三大挑战 —— 肿瘤微环境(TME)模拟不全(解决方案:共培养免疫细胞 / CAFs)、冷冻保存困难(解决方案:优化保护剂)、器官间互作缺失(解决方案:多器官芯片),直观呈现技术瓶颈与突破路径。
肝癌类器官作为精准医学的关键模型,通过保留原发肿瘤的遗传异质性和微环境特征,在药物筛选(如识别 13 种广谱有效药物)、耐药机制研究(如 mTOR 通路介导的索拉非尼耐药)、免疫治疗评估等方面展现独特价值。结合微流控、3D 生物打印等技术,其生理相关性不断提升,但仍面临 TME 模拟不完整、标准化不足等挑战。未来需通过共培养系统优化微环境、推动自动化培养平台建设、建立多器官类器官芯片,加速从基础研究到临床转化,为肝癌个性化治疗提供更可靠的工具。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
下一篇:肺类器官向临床应用的进展:全球研究焦点与未来方向综述