常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-09-13 09:24:38 细胞资源库平台 访问量:166
英文标题:Functional artemisinin derivative‑engineered nanohybrids boost ferroptosis stress‑driven cancer therapy
中文标题:功能性青蒿素衍生物工程纳米杂化物促进铁死亡应激驱动的癌症治疗
发表期刊:《Advanced Composites and Hybrid Materials》
影响因子:21.8
作者单位:沈阳药科大学、辽宁省肿瘤医院
作者信息:
Pengfei Wang, Xinxin Sun, Chengcheng Feng, Shiwen Liu, Qin Chen, Shenwu Zhang, Jin Sun, Zhonggui He, Yuequan Wang, Cong Luo
铁死亡疗法的挑战:
铁死亡是一种新兴的癌症治疗策略,但其临床转化受限于肿瘤中铁水平不均一和固有的抗氧化防御机制。
青蒿素的潜力与局限:
青蒿琥酯(ART)可通过Fe²⁺介导的过氧桥断裂产生活性氧(ROS),但其疗效受限于细胞内Fe²⁺浓度不足。
研究创新点:
设计并合成了青蒿素-二茂铁共轭物(ART-Fc, AF),实现局部供铁和分子内电子转移,显著增强ROS生成。
构建了AF与索拉非尼(Sor)的二元纳米组装体(P-AFS NAs),实现“铁超载/ROS爆发/GSH耗竭”三重打击策略。
AF的合成与表征:
通过酯化反应将ART与二茂铁(Fc)共价连接,经核磁共振(NMR)和质谱(MS)验证结构。
ROS生成与细胞毒性评估:
使用MB降解实验、DCFH-DA探针、MTT法等评估AF的ROS生成能力和细胞毒性。
纳米组装体构建:
采用一步纳米沉淀法制备AF与Sor的二元纳米颗粒(B-AFS NAs),并用DSPE-SS-PEG₂₀₀₀进行表面修饰(P-AFS NAs)。
体内外药效与机制研究:
细胞水平:检测铁含量、GSH、GPX4、LPO、MDA等指标。
动物模型:异位和原位4T1、E0771三阴性乳腺癌模型,评估肿瘤生长、生存期、组织病理等。
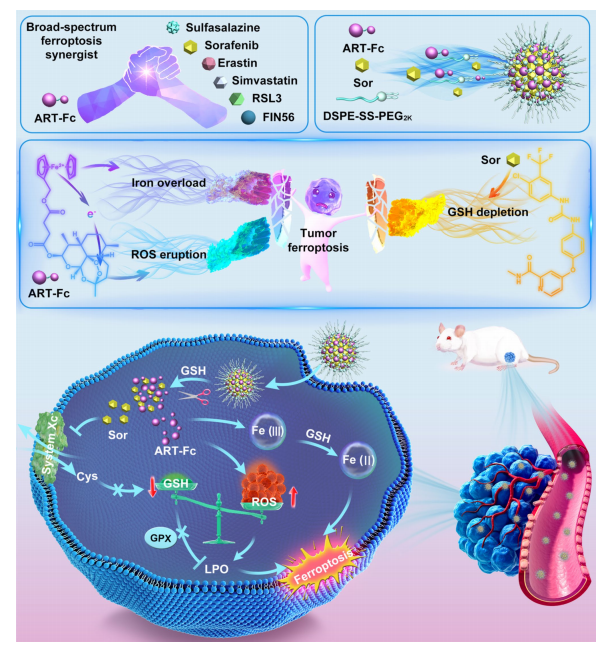
图1:功能性青蒿素衍生物工程纳米杂化体的示意图:通过协同铁死亡疗法驱动癌症治疗。
研究人员精心设计并合成了分子定制的自激活供铁偶联体(ART-Fc),作为广谱铁死亡协同剂。经过严格筛选发现,ART-Fc与索拉非尼(Xc−受体抑制剂)的组合展现出无与伦比的协同效应,超越了其他测试的铁死亡诱导剂。ART-Fc与索拉非尼无需载体材料即可轻松共组装。经可还原切割的DSPE-SSPEG2000修饰后,这种二元纳米组装体通过铁过载/活性氧爆发/谷胱甘肽耗竭“三重打击”对肿瘤模型中的三阴性乳腺癌实现显著的肿瘤铁死亡诱导效果。
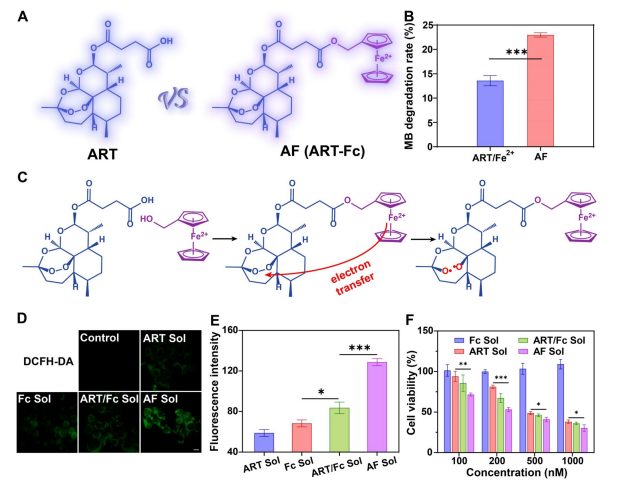
图2:铁死亡协同剂的分子定制化设计
(A) 广谱铁死亡协同剂理性设计示意图。
(B) MB降解归因于ART/Fe.2+和AF产生的活性氧(ROS)。数据以均值±标准差表示(n=3)。
(C) ART通过邻近铁供应和分子内电子转移促进ROS生成的机制示意图。
(D) 不同制剂处理4T1细胞后ROS的生成情况。比例尺=10μm。
(E) 采用流式细胞术(FCM)对4T1细胞进行ROS生成定量分析。数据以均值±标准差表示(n=3)。
(F) 不同制剂对4T1细胞的细胞毒性作用。数据以均值±标准差表示(n=3)。统计学显著性采用双尾学生t检验计算。*P<0.05,**P<0.01,***P<0.001
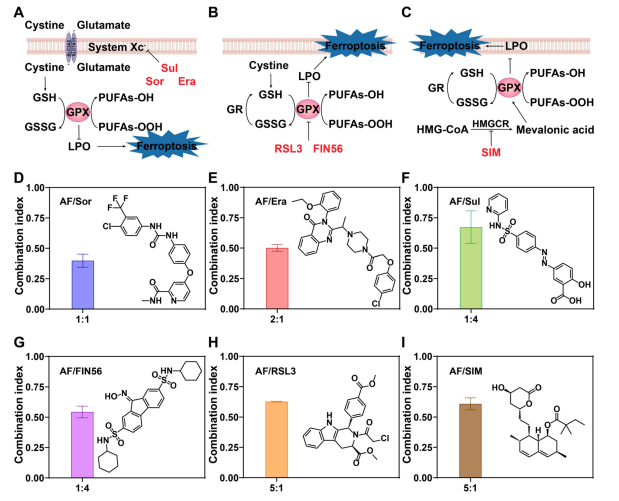
图3:AF作为广谱铁死亡协同剂的性能表现
(A-C) 示意图展示了通过抑制系统Xc.−(苏拉多、索拉多和埃拉)、抑制GPX4(RSL3、FIN56)以及抑制甲羟戊酸途径(SIM)诱导铁死亡的作用机制。
(D-I) 展示了铁死亡诱导剂的化学结构,并确定了不同剂量比例的最佳协同比及与AF的CI值。数据以均值±标准差形式呈现(n=3)
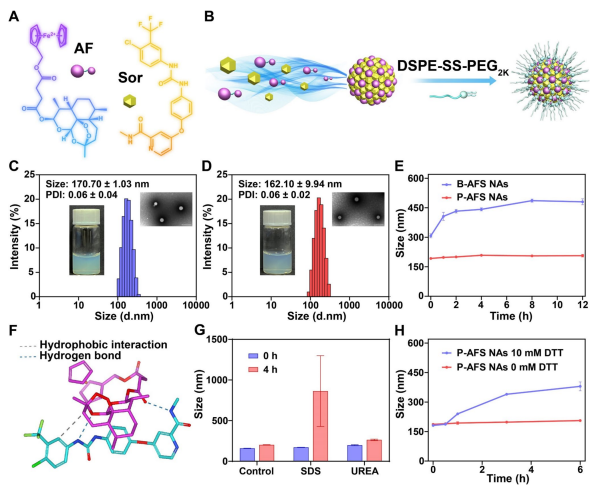
图4:AF/Sor纳米组装的精细制备与表征
(A) AF(自驱动供铁结合物作为广谱铁死亡协同剂)和Sor(系统Xc.−抑制剂)的化学结构。(B)P-AFS纳米组装的二元纳米杂化过程。
(B-D) 分别展示了B-AFS纳米组装和P-AFS纳米组装的颗粒尺寸分布曲线及其对应的TEM图像。数据以均值±标准差表示(n=3)。比例尺=100 nm。
(E) 在PBS(7.4)中37℃孵育12小时后,评估了B-AFS纳米组装和P-AFS纳米组装的胶体稳定性。
(F) AF与Sor的分子对接模拟结果。
(G) B-AFS纳米组装经SDS(10 mM)和尿素(10 mM)处理后的粒径变化。数据以均值±标准差表示(n=3)。
(H) P-AFS纳米组装在PBS(7.4)中孵育后,分别有无DTT(10 mM)处理的粒径变化。数据以均值±标准差表示(n=3)。
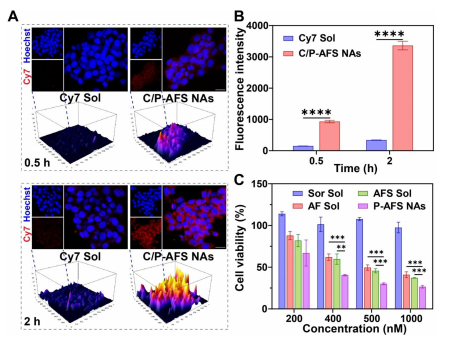
图5:细胞内化与协同细胞毒性
(A) 共聚焦激光扫描显微镜(CLSM)成像及三维表面图,展示经Cy7 Sol和C/P-AFS纳米颗粒处理的4T1细胞在0.5小时和2小时后的细胞摄取情况。比例尺=20μm。
(B) 通过流式细胞术(FCM)定量分析Cy7 Sol和C/P-AFS纳米颗粒处理4T1细胞0.5小时与2小时后的细胞摄取数据,结果以均值±标准差表示(n=3)。
(C) 不同处理条件下对4T1细胞的细胞毒性评估,数据以均值±标准差呈现(n=3)。统计学显著性通过双尾学生t检验计算,**P<0.01,***P<0.001,****p<0.0001
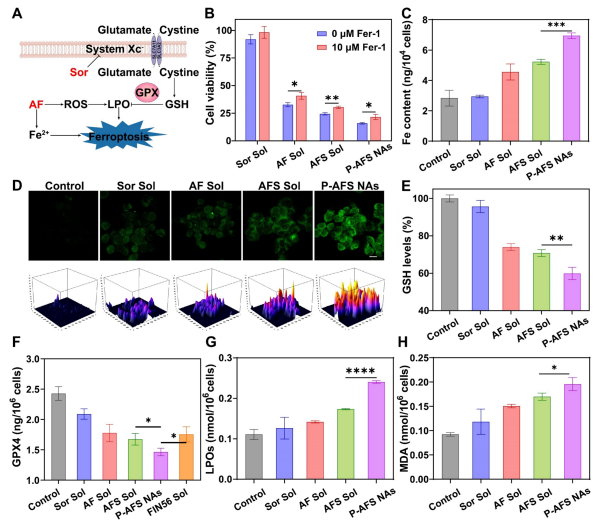
图6:AF与Sor协同作用机制解析
(A) 示意图展示AF与Sor的协同效应。
(B) 不同处理方案(含或不含Fer-1)对4T1细胞铁死亡的影响,数据以均值±标准差表示(n=3)。(C)不同处理条件下4T1细胞内铁含量变化,数据以均值±标准差呈现(n=3)。
(C) 荧光显微镜图像及三维表面图展示不同处理条件下的活性氧水平,比例尺=10μm。
(D) 不同处理方案下4T1细胞内谷胱甘肽水平检测,数据以均值±标准差表示(n=3)。
(E) 不同处理方案下4T1细胞内谷胱甘肽过氧化物酶4(GPX4)水平检测,数据以均值±标准差呈现(n=3)。
(F) 不同干预措施下4T1细胞内脂质过氧化物(LPO)水平变化,数据以均值±标准差表示(n=3)。
(H) 不同处理方案下4T1细胞内丙二醛(MDA)水平检测,数据以均值±标准差呈现(n=3)。统计学显著性采用双尾学生t检验计算。*P<0.05,**P<0.01,***P<0.001,****P<0.0001
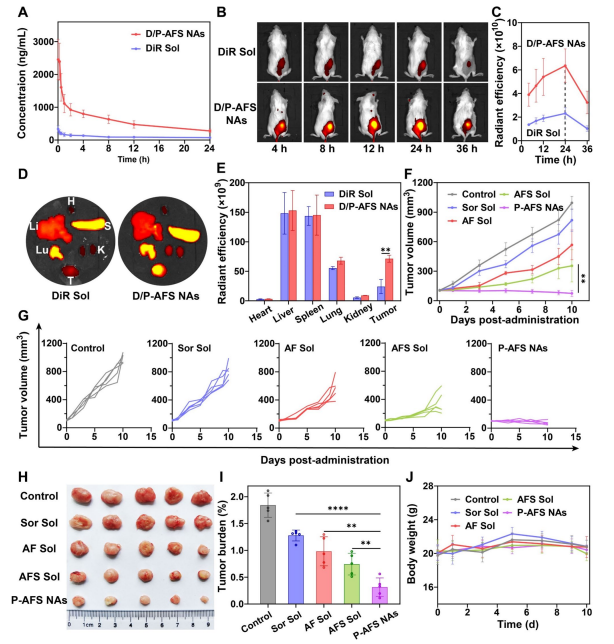
图7:体内分布与抗肿瘤活性
(A) 不同制剂静脉注射后DiR浓度随时间变化曲线。数据以均值±标准差表示(n=5)。(B)BALB/c小鼠携带4T1肿瘤异种移植瘤后,静脉注射不同制剂在不同时间点的体内荧光成像。
(B) 不同制剂分阶段静脉注射后的定量荧光图像评估。数据以均值±标准差表示(n=3)。
(C) 肿瘤及关键器官在亮度峰值时的离体荧光成像。
(D )肿瘤及主要器官在亮度峰值时的离体图像荧光强度定量分析。数据以均值±标准差表示(n=3)。
(E) 不同治疗方案下BALB/c小鼠4T1肿瘤异种移植瘤的生长动态。数据以均值±标准差表示(n=5)。
(F) 不同治疗方案下BALB/c小鼠4T1肿瘤异种移植瘤的个体生长轨迹。数据以均值±标准差表示(n=5)。(H)最终治疗后肿瘤的成像结果(n=5)。
(I) 不同治疗方案下BALB/c小鼠4T1肿瘤异种移植瘤的肿瘤负荷评估。数据以均值±标准差表示(n=5)。
(J) BALB/c小鼠4T1肿瘤异种移植瘤在治疗全程中的体重波动情况。数据以均值±标准差表示(n=5)。统计学显著性通过双尾学生t检验计算。*P<0.05,**P<0.01,****P<0.0001
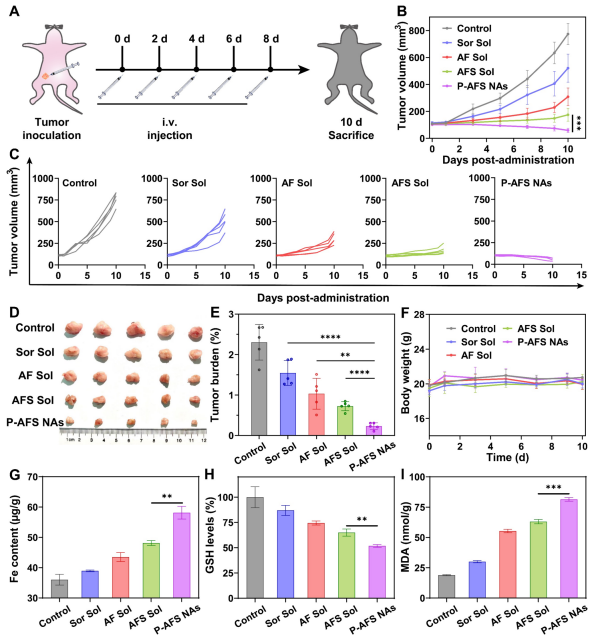
图8:“三管齐下”铁死亡驱动的肿瘤根除在4T1原位BALB/c小鼠模型中的应用。
(A) 示意图展示治疗时间线。
(B) BALB/c小鼠原位4T1肿瘤接受不同治疗后的生长曲线。(数据以均值±标准差表示,n=5)
(C) BALB/c小鼠原位4T1肿瘤接受不同治疗后的生长曲线。(数据以均值±标准差表示,n=5)
(D) 最终治疗后肿瘤组织的显微照片。(数据以均值±标准差表示,n=5)
(F) 不同治疗方案下BALB/c小鼠原位肿瘤负荷评估。(数据以均值±标准差表示,n=5)
(G) 治疗期间BALB/c小鼠原位肿瘤体重变化。(数据以均值±标准差表示,n=5)
(H) BALB/c小鼠原位4T1肿瘤接受不同治疗后肿瘤组织铁含量检测。(数据以均值±标准差表示,n=3)
(I) BALB/c小鼠原位4T1肿瘤治疗后肿瘤组织谷胱甘肽水平评估。(数据以均值±标准差表示,n=3)
(J) BALB/c小鼠原位4T1肿瘤治疗后肿瘤组织丙二醛水平分析。(数据以均值±标准差表示,n=3)统计学显著性采用双尾t检验计算。**P<0.01,***P<0.001,****P<0.0001
AF显著增强ROS生成和铁死亡敏感性,与多种铁死亡诱导剂(如Sor、Era、SIM等)表现出协同效应。P-AFS NAs具有良好的稳定性、肿瘤靶向性和还原响应释放特性。在多种TNBC模型中,P-AFS NAs显著抑制肿瘤生长,并通过铁超载、ROS爆发和GSH耗竭协同诱导铁死亡。
1. ART-Fc(AF)作为一种广谱铁死亡增效剂,可通过局部供铁和分子内电子转移显著增强ROS生成。
2. AF与Sor联用表现出强协同效应,尤其在1:1摩尔比时效果最佳。
3. P-AFS NAs通过“铁超载/ROS爆发/GSH耗竭”三重机制协同诱导铁死亡,在多种TNBC模型中展现出显著抗肿瘤效果。
4. 该纳米平台具有良好的生物相容性和临床转化潜力。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:吉瑞替尼作为AXL抑制剂在人类实体肿瘤中的抗肿瘤活性
下一篇:器官芯片体外建模器官间串扰:多器官芯片研究心血管-肾脏-代谢综合征