常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-08-30 09:18:31 细胞资源库平台 访问量:49
英文标题:Bone marrow microenvironment-responsive polymeric-drug/siRNA regulates leukemia stem cells assisting for prevention of AML relapse
中文标题:骨髓微环境响应性聚合物-药物/siRNA调控白血病干细胞,助力预防AML复发
发表期刊:《Biomaterials》
影响因子:12.9
作者单位:中山大学药学院(深圳)、中山大学药学院(广州)、中山大学实验动物中心
作者信息:
Shihong Cheng, Xiaohan Kong, Yiqiu Zhang, Jianing Gong, Han Wang, Wei Duan, Chujie Li, Xiyan Wang, Yan Xiao, Qiyue Wang, Yang Liu
急性髓系白血病(AML)的现状与挑战
AML是一种恶性血液肿瘤,预后较差,主要原因是现有疗法难以有效靶向白血病干细胞(LSCs)。LSCs能够迁移至骨髓的缺氧微环境中,逃避化疗药物的杀伤并维持其干细胞特性,导致疾病复发。
LSCs的耐药机制
LSCs通过CXCR4/CXCL12轴归巢至骨髓微环境,并依赖线粒体自噬(mitophagy)维持其干细胞特性。抑制CXCR4/CXCL12轴或线粒体分裂蛋白Fis1的表达可削弱LSCs的耐药性。
研究创新点
设计了一种骨髓微环境响应性聚合物-药物/siRNA递送系统(PPLFazo/siFis1@C),能够精准共递送CXCR4拮抗剂plerixafor和靶向Fis1的siRNA。
通过抑制CXCR4/CXCL12轴和下调Fis1表达,阻断LSCs迁移并抑制线粒体自噬,从而削弱LSCs的干细胞特性。
纳米复合物的设计与合成
合成含偶氮苯连接子的聚合物PPLFazo,用于负载siFis1。
通过肽涂层(C)增强骨髓靶向性,涂层序列为DDDDDDPVGLIGDDDDDD,可被骨髓中高表达的MMP-2和Ca²⁺响应性降解。
体外实验
细胞摄取实验: 通过流式细胞术和共聚焦显微镜验证PPLFazo/siFis1@C在白血病细胞(C1498和KG-1)中的摄取效率。
基因沉默效率: 通过RT-qPCR和Western blot检测Fis1 mRNA和蛋白的表达水平。
线粒体自噬抑制: 通过JC-1染色和LC3-II/LC3-I比值评估线粒体膜电位和自噬水平。
体内实验
骨髓靶向性: 通过荧光成像验证PPLFazo/siFis1@C在AML小鼠模型中的骨髓富集能力。
治疗效果: 联合化疗药物mitoxantrone,评估对肿瘤生长、脾脏重量、白细胞计数和生存期的影响。
LSCs清除: 通过流式细胞术检测骨髓中CD33⁺和CD47⁺细胞的比例,评估LSCs的清除效果。
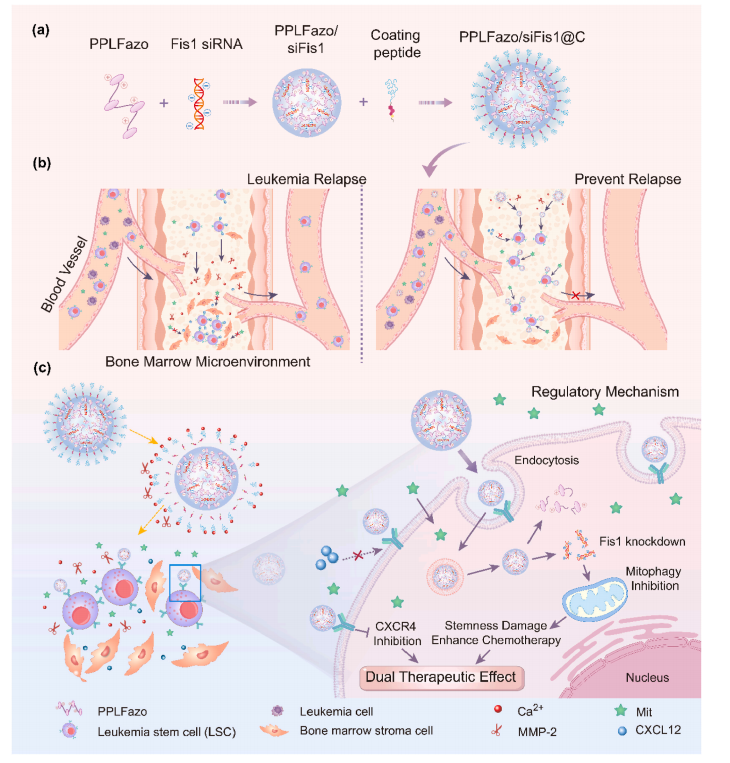
图1:PPLFazo/siFis1@C在骨髓微环境中调控LSCs以联合化疗预防AML复发的制备原理、靶向机制及治疗效果示意图
(a) PPLFazo/siFis1@C的制备流程。
(b) 该药物通过调控LSCs迁移、削弱其干性特征,并增强化疗药物的细胞毒性作用,从而有效预防AML复发。
(c) PPLFazo/siFis1@C在骨髓微环境中响应性脱离包被的特性,以及其对LSCs的双重治疗调控机制。
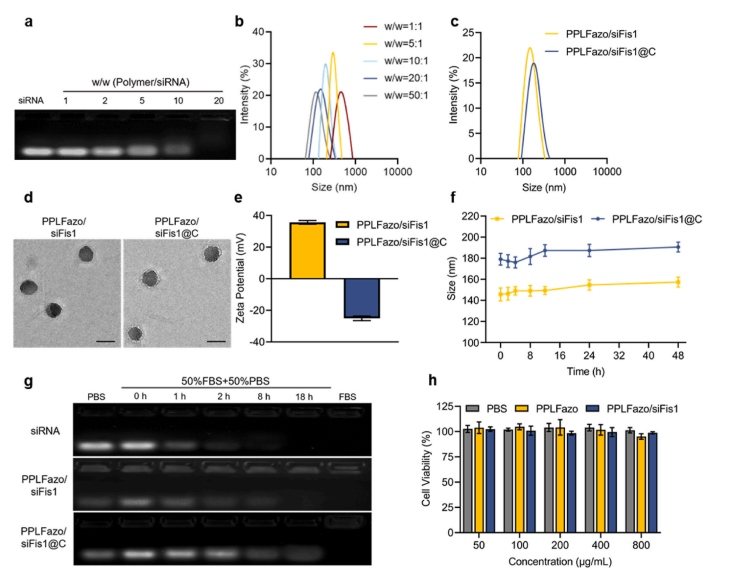
图2:PPLFazo/siFis1@C纳米颗粒的制备与表征
(a) 通过琼脂糖凝胶电泳评估不同质量比(w/w = PPLFazo:siRNA)下PPLFazo/siFis1的凝聚效率。
(b) 不同凝聚比下PPLFazo/siFis1的粒径分布。
(c) 质量比= 20:1时PPLFazo/siFis1和PPLFazo/siFis1@C的粒径分布。
(d) PPLFazo/siFis1和PPLFazo/siFis1@C的透射电镜图像.
(e) PPLFazo/siFis1和PPLFazo/siFis1@C的Zeta电位。比例尺为200纳米。
(f) PPLFazo/siFis1和PPLFazo/siFis1@C在37◦C PBS中孵育48小时后的粒径变化。
(g) 通过琼脂糖凝胶电泳评估PPLFazo/siFis1和PPLFazo/siFis1@C在50 %血清条件下的siRNA稳定性。
(h) 不同浓度PPLFazo和PPLFazo/siFis1处理的3T3细胞活力检测。
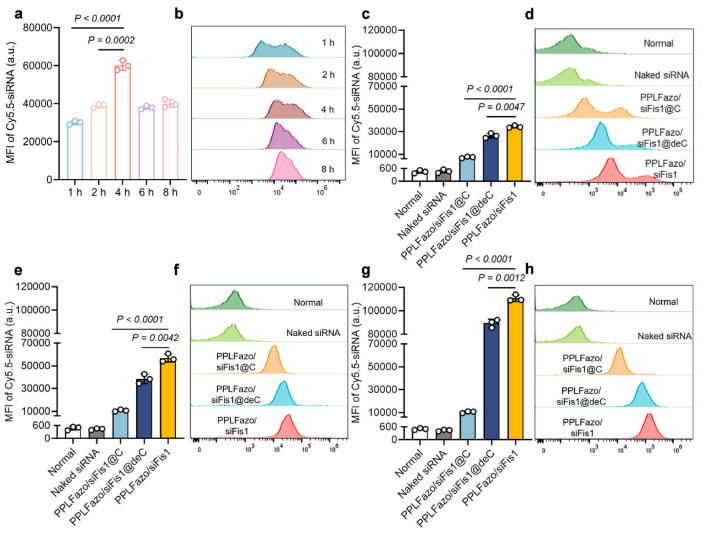
图3:C1498细胞对不同纳米颗粒摄取的流式细胞术分析
单向荧光强度分析(a)和直方图(b) (n = 3,数据以均值±标准差表示)显示C1498细胞在不同孵育时间下对PPLFazo/siFis1的摄取情况。单向荧光强度分析(c)和直方图(d) (n = 3,数据以均值±标准差表示)展示低CXCR4表达的C1498细胞对不同纳米颗粒的摄取情况。单向荧光强度分析(e)和直方图(f) (n = 3,数据以均值±标准差表示)呈现正常C1498细胞对不同纳米颗粒的摄取情况。单向荧光强度分析(g)和直方图(h) (n = 3,数据以均值±标准差表示)则显示高CXCR4表达的C1498细胞对不同纳米颗粒的摄取情况。
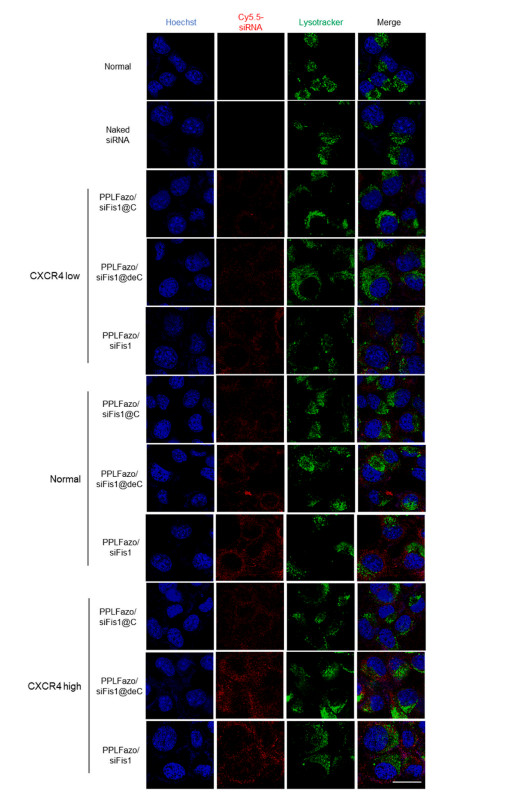
图4:
低CXCR4表达C1498细胞、正常C1498细胞及高CXCR4表达C1498细胞中游离siRNA与不同纳米颗粒的细胞摄取及溶酶体逃逸能力共聚焦成像。(蓝色为Hoechst 33342染色,绿色为Lysotracker green标记的溶酶体,红色为Cy5.5染料偶联siRNA(Cy5.5-siRNA),比例尺为20μm)(关于图例中颜色标注的解释,请读者参阅本文网络版)。
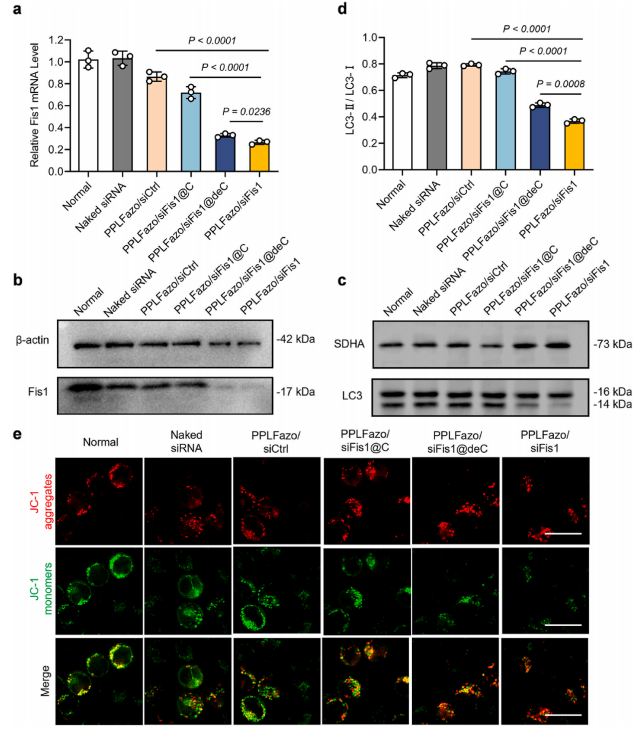
图5:不同纳米颗粒在C1498细胞中对Fis1基因敲低能力的评估及线粒体自噬抑制效果
(a) RT-qPCR检测C1498细胞经不同处理后Fis1 mRNA水平变化(数据以均值±标准差表示,n = 3,采用Student‘s t检验分析统计学差异)。
(b) Western blot检测C1498细胞经不同处理后Fis1表达水平变化。
(c) Western blot检测C1498细胞线粒体蛋白中LC3表达水平变化。
(d) 使用ImageJ软件对(c)中LC3-II/I表达水平进行半定量分析。
(e) JC-1标记的C1498细胞线粒体膜电位共聚焦显微图像(绿色代表JC-1单体,红色代表JC-1聚集体,比例尺为20 μm)。
(关于图例中颜色标注的解释,请参阅本文网络版)
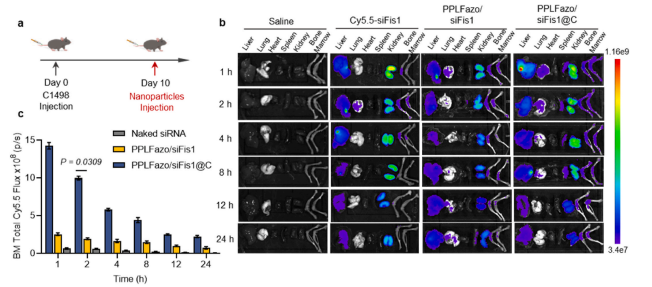
图6:PPLFazo/siFis1@C在急性髓系白血病(AML)小鼠中的生物分布及骨髓靶向效果
(a) AML小鼠纳米颗粒分布实验的时间安排。
(b) 不同治疗组AML小鼠离体器官荧光成像结果,荧光信号来源于Cy5.5标记的siRNA。
(c) 离体荧光成像结果的半定量统计分析(n = 4)。
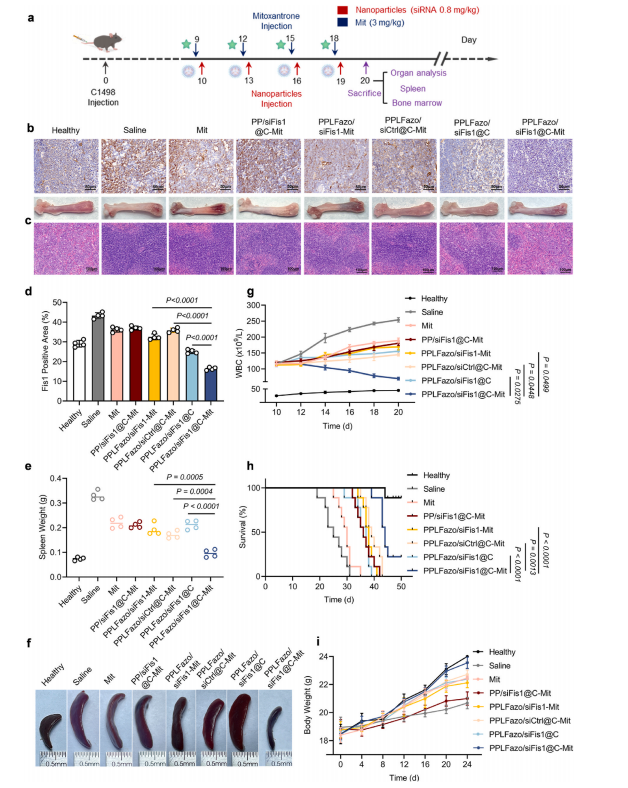
图7:PPLFazo/siFis1@C在AML小鼠模型中的治疗方案及初始疗效。
(a) 药效学评估的治疗方案。
(b) 股骨Fis1蛋白免疫组化染色结果(上排)、各组小鼠股骨照片(下排)及(c)不同治疗组小鼠脾脏H&E染色图像。
(c) 通过ImageJ软件对(b)中Fis1免疫组化结果进行半定量统计(n = 4).
(d) 不同治疗组小鼠脾脏重量对比(n = 4).
(e) 不同治疗组小鼠脾脏照片。
(f) 治疗期间静脉血白细胞计数(n = 4).
(g) 不同治疗组AML小鼠生存曲线(n = 9).
(h) 实验期间不同治疗组AML小鼠体重监测仪数据。数据以均值±标准差表示。统计学显著性采用非配对t检验,每根柱状图代表均值±标准差,每个数据点为独立样本的测量值。
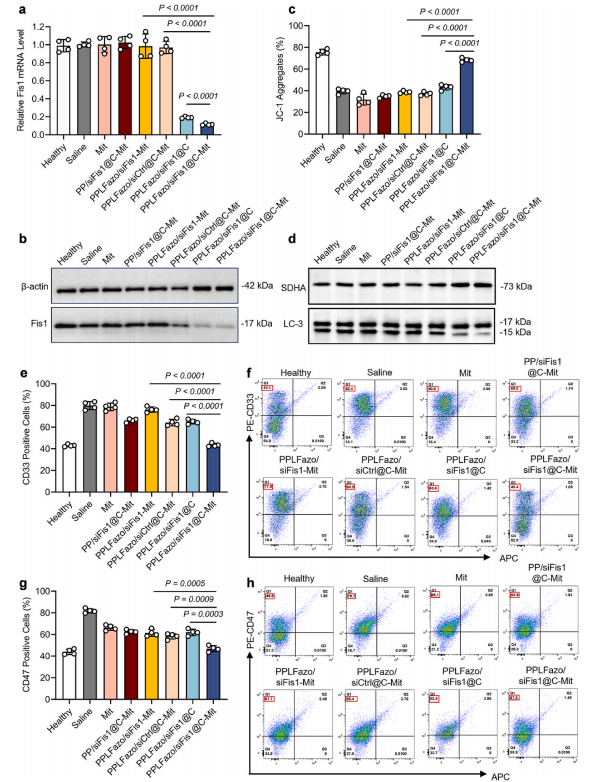
图8:PPLFazo/siFis1@C在AML小鼠中的基因敲低及LSCs清除效率。
(a) 通过RT-qPCR分析不同处理下小鼠骨髓组织中Fis1 mRNA水平变化(数据以均值±标准差表示,n = 3,采用Student‘s t检验进行统计学分析)。
(b) 通过Western blot检测不同处理下小鼠骨髓组织中Fis1表达水平变化。
(c) 通过JC-1标记的流式细胞术分析骨髓组织线粒体膜电位(数据以均值±标准差表示,n = 4). (d)通过Western blot检测不同处理下骨髓组织线粒体蛋白LC3表达水平变化。
(e-f) 定量流式细胞术分析AML小鼠骨髓组织中髓系细胞标志物CD33信号(数据以均值±标准差表示,n=4).
(g-h) 定量流式细胞术分析AML小鼠骨髓组织中白血病干细胞标志物CD47信号(数据以均值±标准差表示,n = 4)。
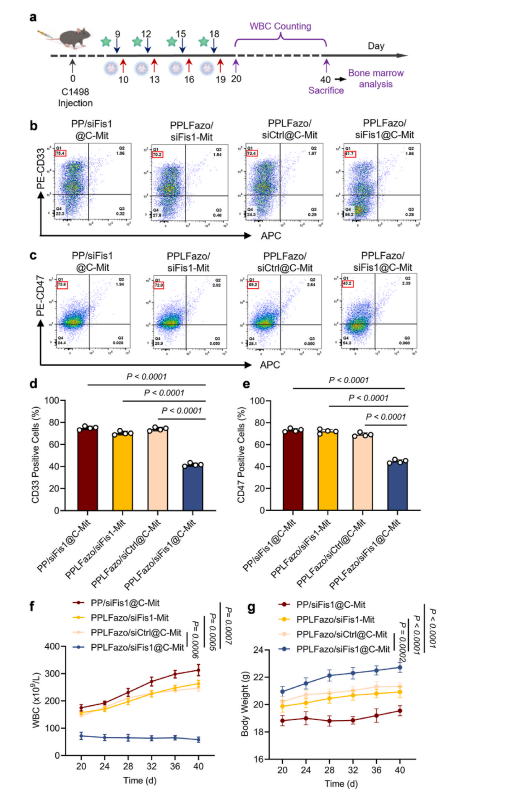
图9:不同治疗方案对急性髓系白血病(AML)复发的抑制效果评估。
(a) 治疗时间安排及AML复发检测流程。
(b) AML小鼠骨髓组织中髓系细胞标志物CD33信号的流式细胞术分析。
(c) AML小鼠骨髓组织中髓系细胞标志物CD47信号的流式细胞术分析。
(d-e) CD33+和CD47+细胞流式分析结果的定量统计学分析。采用非配对t检验评估P值(数据以均值±标准差表示,n = 4)。
(f) 不同治疗方案下AML小鼠治疗结束至第40天的白细胞计数变化(n = 3)。
(g) 小鼠从第20天至第40天的体重变化情况(n = 4)。
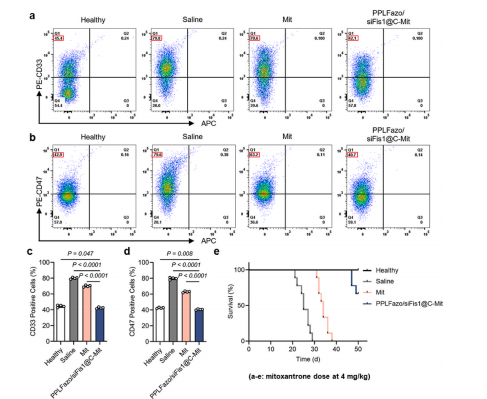
图10:马托蒽醌剂量优化联合治疗的药效学评估。在AML小鼠模型中,将马托蒽醌剂量增至4 mg/kg,并分别进行单独给药或联合PPLFazo/siFis1@C治疗。
(a) 通过流式细胞术检测骨髓细胞中的髓系细胞标志物CD33信号,评估不同治疗方案对AML小鼠的影响。
(b) 检测骨髓细胞中白血病干细胞标志物CD47信号,评估不同治疗方案对清除骨髓中LSCs的效果。
(c)(d) 分别为(a)和(b)的定量分析结果(数据以均值±标准差表示,n = 4)。
(e) 马托蒽醌剂量增至4 mg/kg后,不同治疗方案对AML小鼠的生存曲线(n = 9)。
体外实验结果:
PPLFazo/siFis1@C显著抑制Fis1表达,降低线粒体自噬水平。在缺氧条件下,PPLFazo/siFis1@C能够高效释放siRNA并实现基因沉默。
体内实验结果:
PPLFazo/siFis1@C在骨髓中显著富集,并有效下调Fis1表达。联合mitoxantrone治疗后,AML小鼠的肿瘤负荷显著降低,生存期延长。流式分析显示,PPLFazo/siFis1@C-Mit组骨髓中CD33⁺和CD47⁺细胞比例显著减少。
创新策略: 通过骨髓微环境响应性纳米递送系统,实现LSCs的双重调控(迁移抑制和干细胞特性削弱)。
转化意义: 为AML复发预防提供了新型联合治疗策略,并展示了聚合物-siRNA纳米复合物的临床潜力。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000