常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-07-30 17:31:46 细胞资源库平台 访问量:161
宫颈癌作为女性恶性肿瘤中的高发病种,其发病率与死亡率均位居前列,其中宫颈鳞状细胞癌(CSCC)占比高达70%。传统治疗手段如手术、放化疗虽为标准疗法,但疗效有限。近年来,免疫检查点抑制剂,尤其是针对PD-1/PD-L1的免疫治疗,为癌症治疗带来突破,然而在CSCC中的临床应答率却不尽如人意,仅达16.4%。
2025年6月27日,发表在Advanced Science上题为Targeting Glutamine Metabolism Transporter SLC25A22 Enhances CD8+ T-Cell Function and Anti-PD-1 Therapy Efficacy in Cervical Squamous Cell Carcinoma: Integrated Metabolomics, Transcriptomics and T-Cell-Incorporated Tumor Organoid Studies的研究聚焦于探索TME中谷氨酰胺代谢对免疫治疗的影响。研究发现,肿瘤细胞通过高摄取谷氨酰胺,营造了不利于免疫细胞功能的代谢环境,进而抑制CD8+ T细胞活性。通过靶向谷氨酰胺代谢转运体SLC25A22,该研究旨在揭示其调控机制,并探索其作为增强CSCC免疫治疗应答新靶点的潜力。
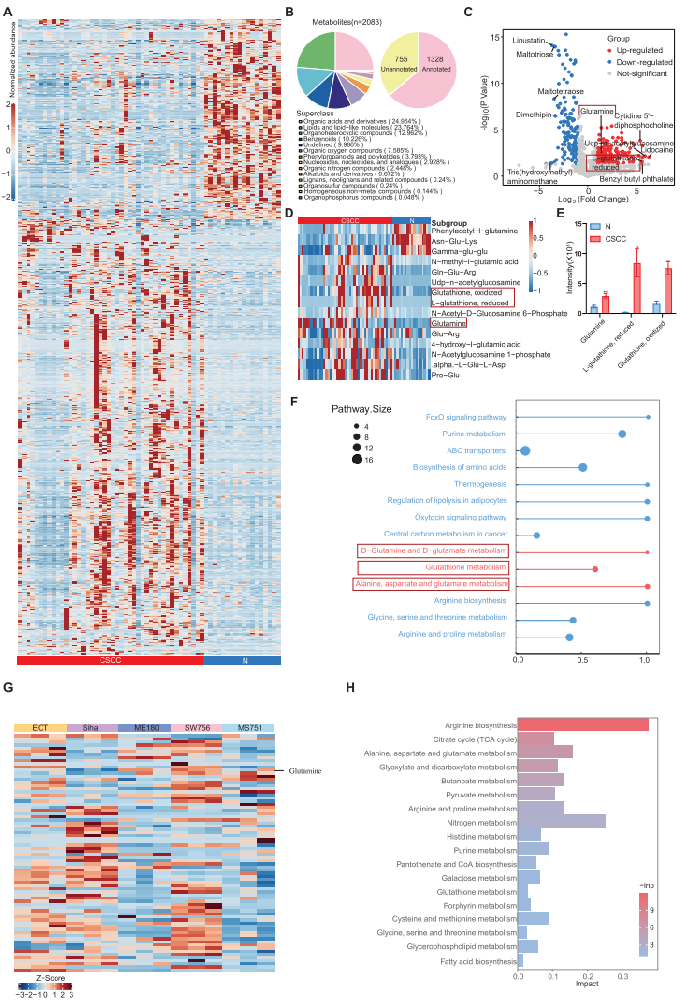
1,代谢组学和转录组学分析揭示CSCC的谷氨酰胺富集和免疫抑制微环境。
通过对44个CSCC组织样本和18个正常组织样本进行代谢组学分析,研究发现共检测到2083种代谢物,其中1328种通过KEGG数据库或人类代谢组数据库注释。在118种差异表达代谢物中,谷氨酰胺相关代谢物包括谷氨酰胺(Gln)和谷胱甘肽(GSH)在CSCC中显著富集。KEGG通路分析表明,大多数差异代谢物与氨基酸代谢通路相关,特别是谷氨酰胺代谢相关通路。为验证CSCC中谷氨酰胺代谢升高的存在,研究还对CSCC细胞系进行了代谢组学分析,发现大多数CSCC细胞系相比正常宫颈细胞系表现出更高水平的谷氨酰胺相关代谢物。转录组学分析显示,CSCC患者表现出增加的免疫细胞浸润,特别是观察到更高丰度的免疫抑制细胞以及免疫反应性CD8+ T细胞浸润的增加。GO分析揭示DEGs在T细胞介导的免疫负调节中富集,KEGG通路分析显示DEGs与癌症中的PD-L1表达和PD-1检查点通路相关。流式细胞术分析证实了免疫细胞如Tregs和CD8+ T细胞潜在增加的浸润,并观察到CSCC中CD8+ T细胞上PD-1表达升高以及PD-1低表达CD8+ T细胞中细胞毒性效应子表达降低。
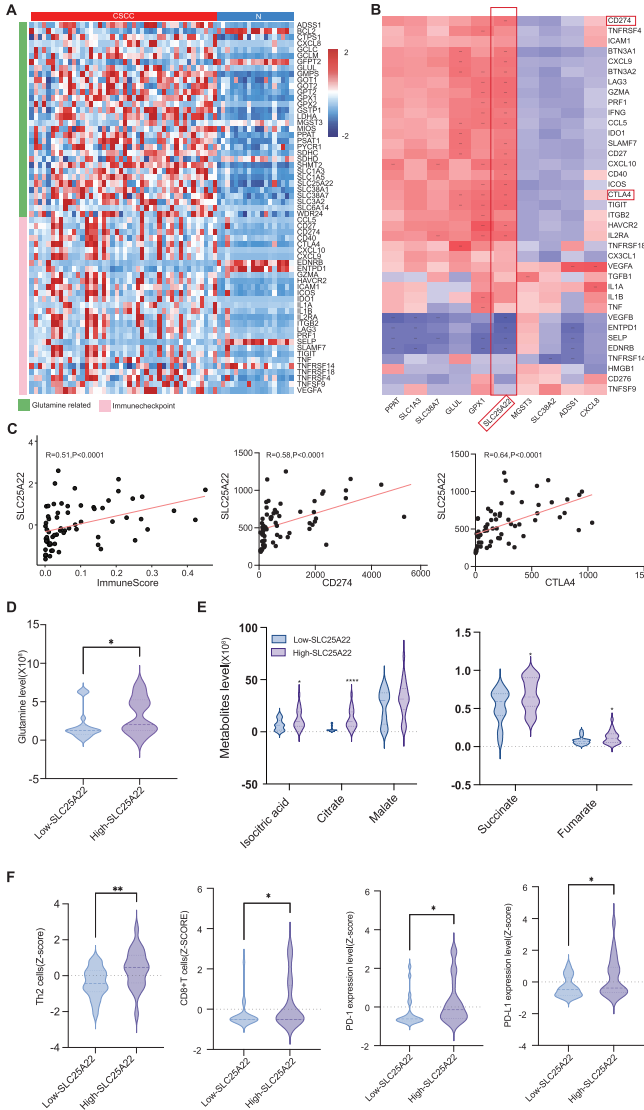
2,整合分析识别SLC25A22作为关键介导因子。
整合代谢组学和转录组学数据分析揭示了谷氨酰胺代谢转运蛋白SLC25A22的重要性。热图分析显示,不仅谷氨酰胺相关基因(包括编码谷氨酰胺利用酶GLS和GFPT1等以及谷氨酰胺转运蛋白SLC1A5、SLC38A1、SLC38A2、SLC6A14和SLC25A22等)上调,免疫检查点基因也上调。相关性分析显示,谷氨酰胺转运蛋白基因SLC25A22与多个免疫检查点基因如CD274(PD-L1)和CTLA-4表现出强正相关性。根据中位表达水平将44名CSCC患者分为SLC25A22高表达组(n=22)和低表达组(n=22),高表达组不仅显示出显著更高的谷氨酰胺水平,还显示出参与三羧酸循环的代谢物含量增加,以及增强的免疫细胞浸润和PD-1等关键免疫检查点分子表达升高。
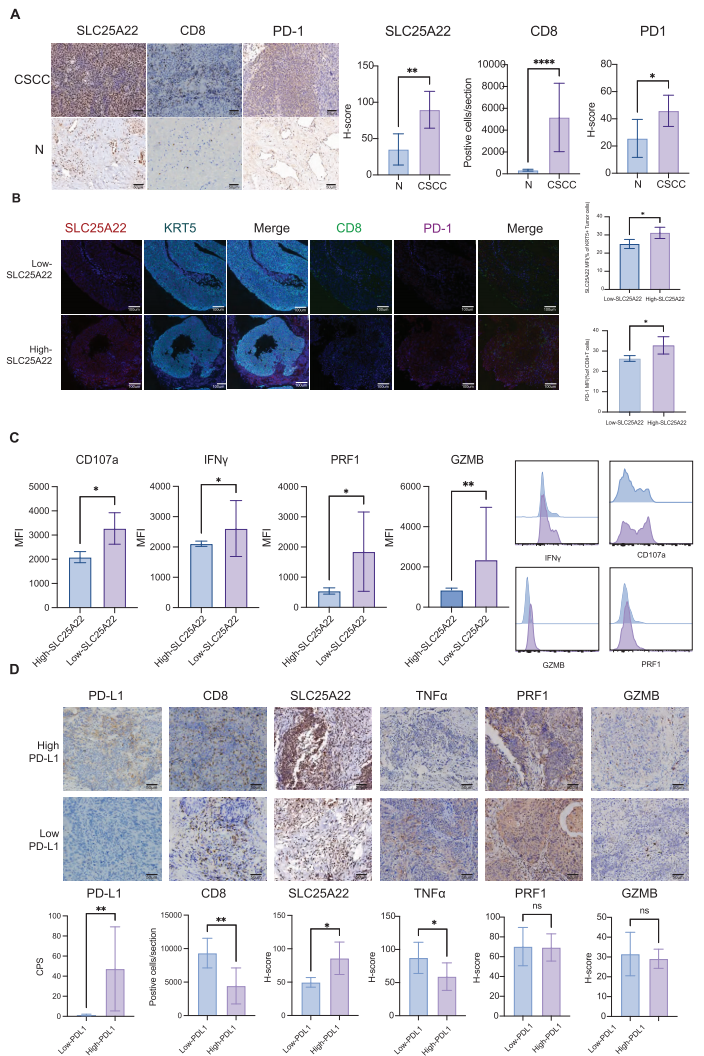
3,临床验证证实SLC25A22和PD-1/PD-L1表达同时增加。
对20个CSCC样本和3个正常样本的临床验证分析显示,与正常组织相比,CSCC组织表现出更高的谷氨酰胺转运蛋白SLC25A22和PD-1表达,以及CD8+ T细胞浸润增加。多重免疫组化染色证实SLC25A22主要定位于上皮细胞而非CD8+ T细胞,并显示CSCC患者不仅SLC25A22表达升高,CD8+ T细胞上PD-1表达也升高。流式细胞术分析结果显示,CD107a、IFNγ、GZMB和PRF1等CD8+ T细胞毒性活性的关键标志物在SLC25A22高表达CSCC组中的表达水平低于低表达组。基于联合阳性评分(CPS)临界值3,将20名CSCC患者分为PD-L1高表达组(n=17)和低表达组(n=3)。PD-L1高表达组患者表现出显著更高的SLC25A22表达和更低的CD8+ T细胞毒性。这些发现提示靶向谷氨酰胺代谢转运蛋白SLC25A22可能具有增强CD8+ T细胞毒性和提高抗PD-1治疗疗效的潜力,特别是对于PD-L1高表达的CSCC患者。
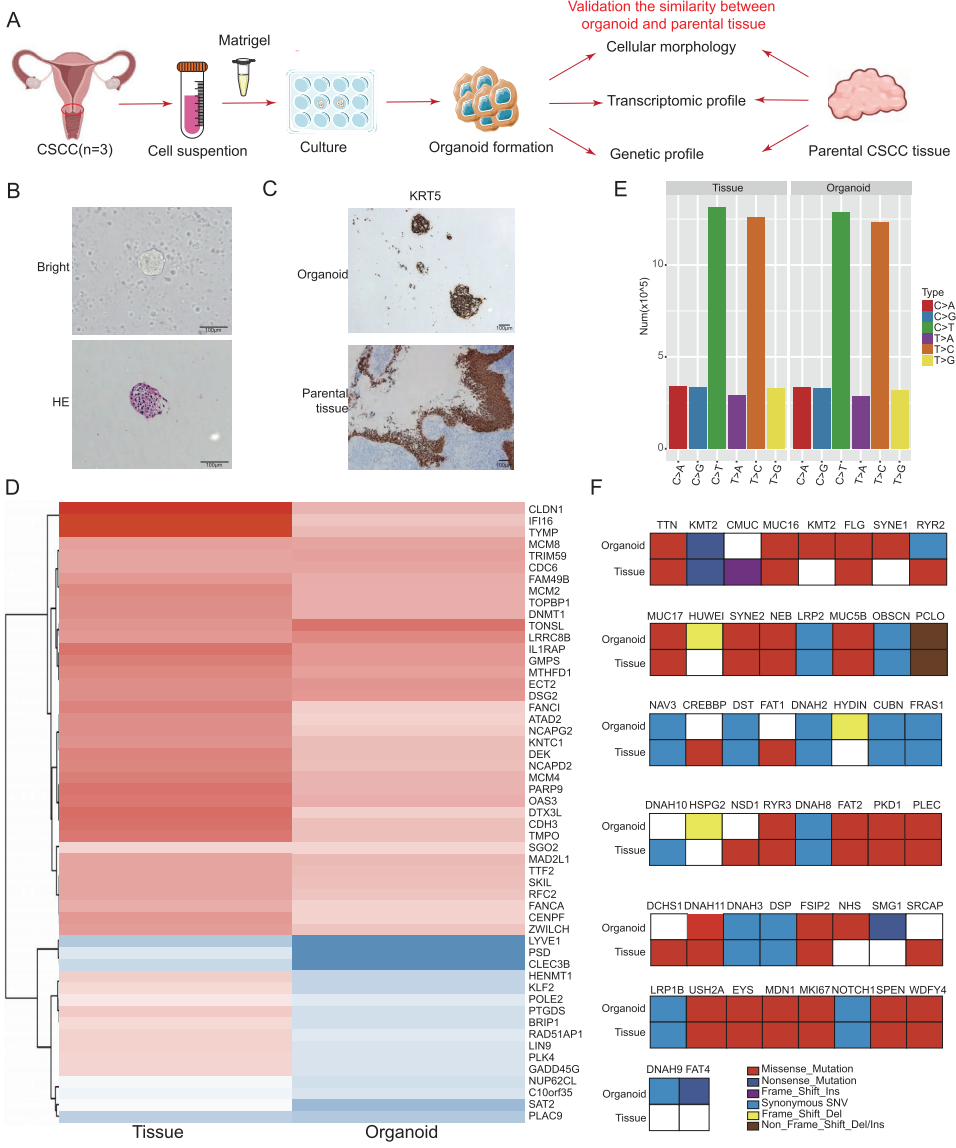
4,3D CSCC类器官模型的构建和验证。
为了重现CSCC中肿瘤细胞与T细胞之间的相互作用,研究首先构建了CSCC衍生的类器官作为体外肿瘤特征模拟平台。HE染色结果显示CSCC衍生类器官保持了原始肿瘤组织的组织结构和细胞形态。免疫组化染色证实鳞状细胞分化标志物KRT5在类器官中得以保留。类器官和匹配组织的转录组测序显示出高度相似的基因表达谱,表明转录组特征在CSCC衍生类器官中得以很大程度保留。全基因组测序分析显示原发肿瘤组织与CSCC衍生类器官之间具有高度一致的突变景观,并观察到频繁突变基因(MUC16、MUC17、KMT2)的存在。进一步构建了3D T细胞整合CSCC类器官模型,通过将CSCC类器官与从外周血单核细胞分离的T细胞共培养,将它们嵌入Matrigel基质中以促进3D T细胞整合CSCC类器官的形成。形态学分析显示T细胞主动包围并浸润CSCC类器官,多重免疫组化染色证实CD8+ T细胞在肿瘤类器官中的包封。流式细胞术分析验证CD8+ T淋巴细胞是共培养系统中的主要免疫细胞群体,功能上证实T细胞整合肿瘤类器官分泌的细胞毒性效应子与原始肿瘤中的相似。
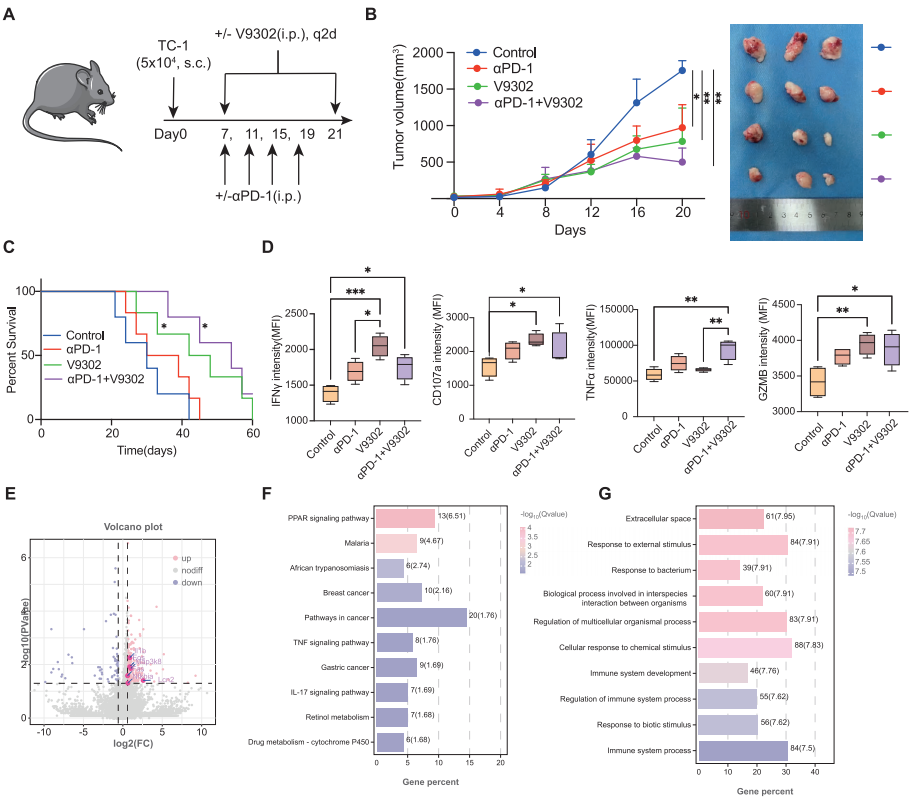
5,V-9302靶向SLC25A22增强免疫治疗效果。
使用3D T细胞整合CSCC类器官模型进行体外验证实验,评估V-9302增强PD-1疗效的效果。结果显示V-9302不仅抑制CSCC类器官中的肿瘤生长,还使3D T细胞整合CSCC类器官对抗PD-1治疗敏感。与抗PD-1单药治疗相比,抗PD-1-V-9302联合治疗增加了CD8+ T细胞中效应细胞因子(TNF-α)的表达和细胞溶解标志物(CD107a、GZMB和PRF1)的释放。体内TC-1肿瘤小鼠模型实验进一步支持了V-9302增强抗PD-1治疗反应的疗效。腹腔注射抗PD-1或V-9302显著降低了肿瘤生长,而V-9302和抗PD-1抗体的联合治疗在控制肿瘤生长和延长荷瘤小鼠生存期方面表现出优于单药治疗的效果。流式细胞术分析显示,与单药治疗组相比,V-9302和抗PD-1联合治疗显著增强了肿瘤浸润CD8+ T细胞中细胞溶解蛋白(GZMB和PRF1)和效应细胞因子(IFN-γ和TNF-α)的表达。转录组测序显示,与PD-1单药治疗组相比,联合治疗组在免疫相关通路如IL-17和TNF信号通路中显著富集,表明V-9302可能通过调节关键免疫相关通路来增强免疫治疗的有效性。
本研究通过多组学整合分析首次系统阐明了CSCC中谷氨酰胺代谢与免疫抑制微环境的关系,识别出SLC25A22作为连接谷氨酰胺代谢、免疫检查点激活和CD8+ T细胞毒性的关键介导因子。研究建立的3D T细胞整合CSCC类器官模型为肿瘤-免疫相互作用研究提供了创新平台,并证实了靶向SLC25A22的治疗策略能够增强CD8+ T细胞功能并改善抗PD-1治疗效果。这些发现为通过代谢调节提高CSCC患者免疫治疗敏感性提供了新的治疗方向,特别是对于PD-L1高表达患者具有重要临床转化意义,为未来的临床试验奠定了基础。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:鼻黏膜修复竟需 7 周才能 "达标"?科学家揭开 EGFR 调控的伤口愈合密码
下一篇:基于头颈癌类器官生成肿瘤特异性T细胞用于过继性细胞治疗