常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-03-29 12:30:00 细胞资源库平台 访问量:479
英文标题:Overexpression of ornithine decarboxylase 1 mediates the immune-deserted
microenvironment and poor prognosis in diffuse large B-cell lymphoma
中文标题:ODC1过表达介导DLBCL免疫沙漠微环境与不良预后
发表期刊:《Journal of the National Cancer Center》
影响因子:7.6
作者单位:
首都医科大学附属北京同仁医院血液科,中国北京
河北大学附属医院肿瘤内科,河北省肿瘤放化疗重点实验室,河北保定
南方医科大学南方医院血液科,中国广州
广东医科大学第一临床医学院,中国湛江
北京航空航天大学机械工程及自动化学院,中国北京
作者信息:
Xiaojie Liang;Jia Guo;Xiaofang Wang;Baiwei Luo;Ruiying Fu;Haiying Chen;Yunong Yang;Zhihao Jin;Chaoran Lin;Aimin Zang;Youchao Jia;Lin Feng;Liang Wang
弥漫性大B细胞淋巴瘤(DLBCL)是常见淋巴瘤类型,部分患者对标准化疗无反应或缓解后复发,需探索新的生物标志物和靶点。
Malata等人用一类逻辑回归(OCLR)机器学习算法计算干性指数评估肿瘤去分化程度,可发现相关生物学机制和肿瘤免疫微环境特征。
此前DLBCL的某些亚组中有肿瘤干细胞样细胞特征,但致癌去分化及相关相互作用研究较少。
本研究用OCLR计算干性指数对DLBCL预后风险分类,确定不良预后亚组,并通过多维分析探索形成高危组的潜在机制。
数据来源与处理:
整合2133个DLBCL样本,数据来自GEO和TCGA等数据库。
详细数据处理和分析方法在补充方法中,研究工作流程见补充图1。
特征工程与模型开发验证:
用OCLR算法计算DLBCL的干性指数(mRNAsi)。
通过差异表达分析等确定685个差异表达基因(DEGs),进一步筛选出与总体生存期显著相关的DEGs。
使用LASSO和SVM-RFE算法从预后DEGs中选择特征基因,构建风险模型,将DLBCL队列分为高风险和低风险组。
高、低风险DLBCL转录模式差异评估:
对与B细胞疾病相关的基因集进行基因集变异分析(GSVA)。
下载功能基因表达特征和肿瘤浸润免疫细胞类型的基因集进行进一步分析
细胞与细胞培养:
OCI-LY3和SU-DHL-4细胞的培养条件。
THP-1细胞的培养及分化为M0表型的方法。
质粒构建。
RNA提取与定量实时聚合酶链反应(qRT-PCR)。
蛋白质提取与Western blot分
细胞增殖测定。
集落形成测定。
共培养。
流式细胞术分析。
酶联免疫吸附测定(ELISA)。
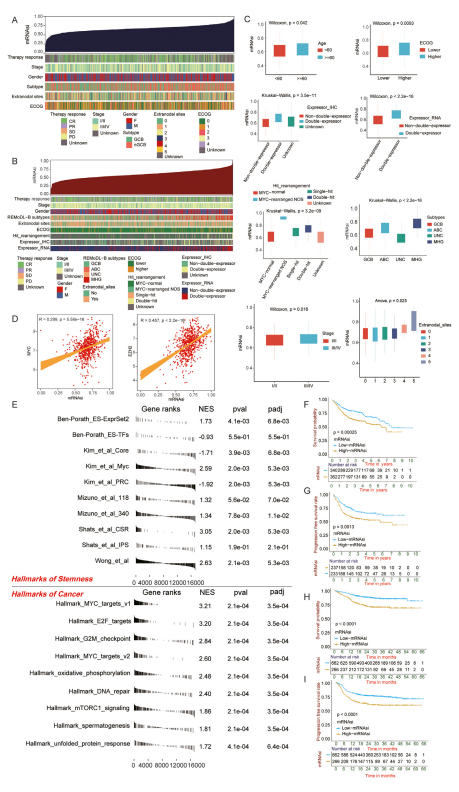
图1:DLBCL中的致癌去分化样特征。
(A,B)DLBCL训练队列(A)和GSE117556队列(B)中干性指数与已知临床和分子特征之间关联的概述。列代表按mRNAsi从低到高排序的样本(顶行),行代表与mRNAsi相关的人口统计学和亚型。
(C)不同临床亚组之间mRNAsi的差异。使用荧光原位杂交(FISH)检测MYC、BCL2和BCL6重排;单打击表示MYC重排,BCL2和BCL6无重排;MYC重排NOS表示MYC重排,BCL2和BCL6的重排状态未知;双打击表示MYC和BCL2和/或BCL6重排。Expressor_RNA表示在mRNA水平上评估MYC和BCL2联合高表达的样本。Expressor_IHC,表示通过免疫组织化学(IHC)研究MYC和BCL2蛋白表达的样本。
(D)mRNAsi与核心癌症干细胞因子MYC和EZH2的相关性。
(E)GSEA显示在代表干性和癌症特征的基因集背景下评估mRNAsi。
(F - I)生存分析表明,mRNAsi与训练队列的总生存率(OS)率(F)、GSE31312队列的无进展生存率(PFS)率(G)、GSE117556队列的OS(H)和PFS(I)率密切相关。OS,总生存期;PFS,无进展生存期。ABC,活化B细胞样;CR,完全缓解;DLBCL,弥漫性大B细胞淋巴瘤;ECOG,东部肿瘤协作组;F,女性;GCB,非生发中心B细胞;IHC,免疫组织化学;M,男性;MHG,分子高级别;mRNAsi,基于mRNA表达的干性指数;nGCB,非生发中心B细胞;NOS,未另作说明;PD,疾病进展;PR,部分缓解;SD,疾病稳定;UNC,未分类。
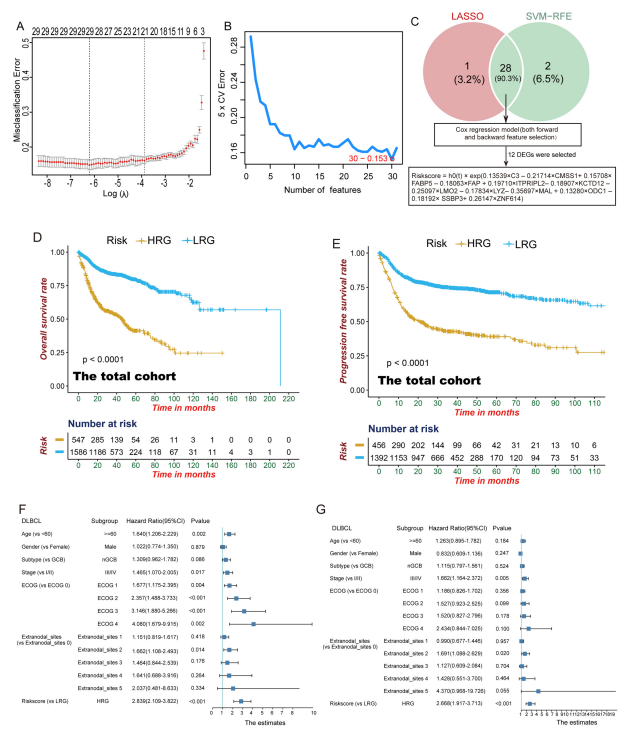
图2:基于12个标志物的模型在DLBCL风险分层中显示出强大的能力
(A,B)结合LASSO(A)和SVM - RFE(B)算法来选择特征基因。
(C)通过维恩图展示两种算法选择出的28个重叠基因。随后,将这28个基因整合到一个惩罚Cox回归模型中进行向前和向后特征选择,将候选基因细化为12个以构建Riskscore(风险评分)。
(D,E)总队列中总体生存期(D)和无进展生存期(E)的Kaplan - Meier曲线表明,我们的风险分层模型具有强大的风险分层能力,能够稳定地对DLBCL的风险进行分层。
(F,G)森林图显示,在调整临床协变量后,高风险组(HRG)独立地预测DLBCL中更差的总体生存期(F)和无进展生存期(G)。HRG,高风险组;LRG,低风险组。
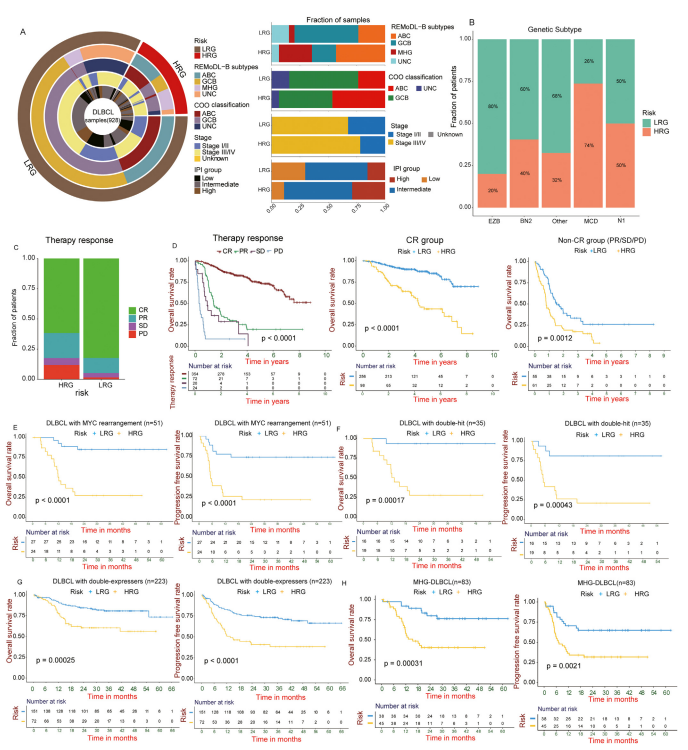
图3:LRG和HRG DLBCLs之间不同的临床特征
(A)基于风险模型的亚组(外环)与已发表的已知临床和分子亚型(内环)的重叠(左图)。柱状图显示了基于风险模型的亚组中COO亚型、REMoDL - B试验亚型、IPI组和肿瘤分期的分布(右图)。
(B)每种基因亚型中HRG和LRG的百分比。
(C)GSE31312队列中HRG和LRG中不同治疗反应的患者比例(双侧Fisher精确检验;P = 2.8e - 07)。
(D)根据对R - CHOP治疗反应的分层,GSE31312队列中DLBCL患者的总体生存期的Kaplan - Meier曲线(左图)。总体生存期的生存曲线,显示了CR组(中图)和非CR组(右图)中对R - CHOP的每个单独反应的患者的风险模型分层。
(E - H)MYC重排(E)、双打击(F)、通过MYC和BCL2的高mRNA转录表达联合评估的双表达者(G)和MHG亚型(H)的HRG和LRG DLBCL患者的总体生存期和无进展生存期的Kaplan - Meier曲线。REMoDL - B,用硼替佐米(Bortezomib)进行弥漫性大B细胞淋巴瘤分子导向治疗的随机评估临床试验。ABC,活化B细胞样;COO,起源细胞;CR,完全缓解;DLBCL,弥漫性大B细胞淋巴瘤;GCB,非生发中心B细胞;HRG,高风险组;IPI,国际预后指数;LRG,低风险组;MHG,分子高级别;PD,疾病进展;PR,部分缓解;SD,疾病稳定;UNC,未分类。
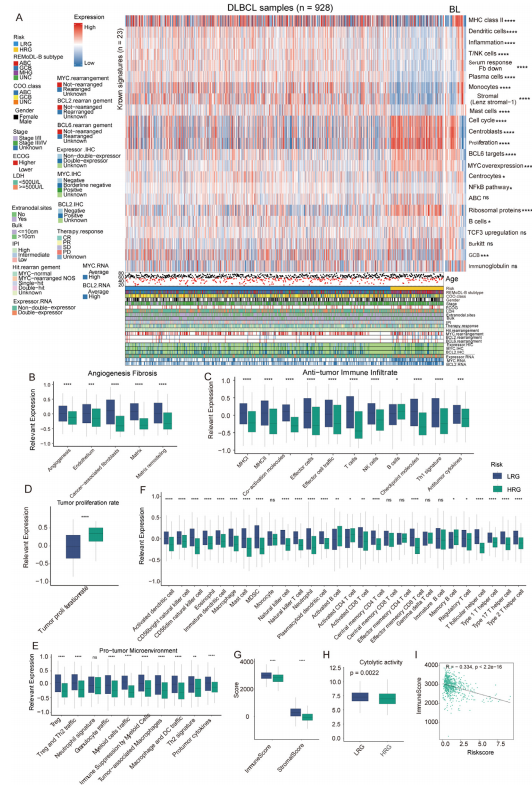
图4:基于风险模型的亚组显示出不同的转录模式
(A)热图显示了GSE117556队列中LRG和HRG DLBCL中所选特征的GSVA富集分数,并在70例BL患者中进行了增强,以比较基因表达模式。
(B - E)GSE117556队列中HRG和LRG DLBCL样本之间的血管生成和纤维化(B)、抗肿瘤免疫浸润(C)、肿瘤增殖率(D)和促肿瘤免疫浸润(E)的差异。
(F)GSE117556队列中HRG和LRG DLBCL样本中TME浸润的先天性和适应性免疫细胞的丰度。(G)训练队列中HRG和LRG DLBCL的免疫评分和基质评分的差异。
(G)训练队列中HRG和LRG DLBCL的细胞溶解活性的差异。
(I)训练队列中免疫评分和Riskscore之间的相关性。对于箱线图,箱内的线代表中位数,箱的上下两端代表值的四分位数范围。
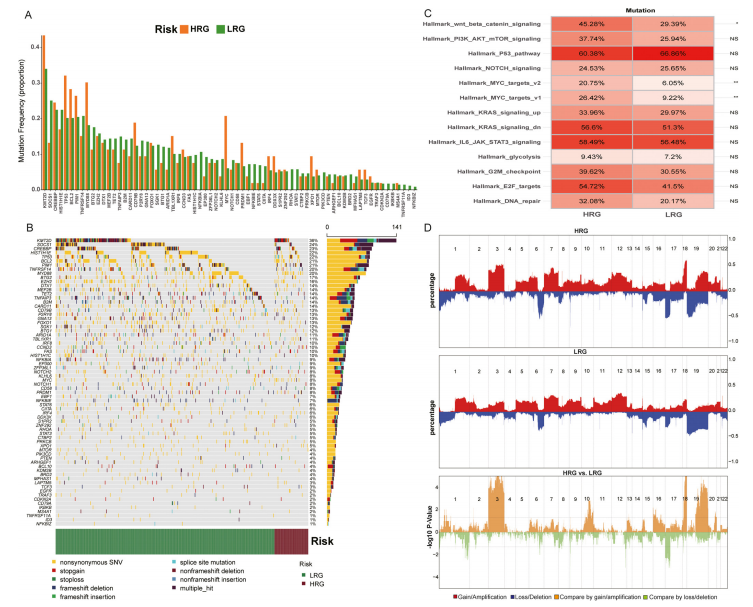
图5:DLBCL中基于风险模型的亚组的基因组改变
(A)REMoDL - B队列中LRG和HRG亚组的400名患者的70基因panel的突变频率。
(B)Oncoplot展示了70个基因的突变类型及其在LRG和HRG DLBCL中的分布。右侧的柱状图概括了每个基因每种突变类型的比例。
(C)REMoDL - B队列中LRG和HRG DLBCL样本中13个癌症标志性通路的基因组改变,颜色的饱和度代表频率(双侧Fisher精确检验,∗P < 0.05;∗∗P < 0.01)。
(D)GSE87371队列中LRG和HRG DLBCL亚组之间的体细胞拷贝数变异(CNAs)的比较。顶部和中间的图显示了HRG和LRG中每个基因的丢失/缺失(蓝色)和增加/扩增(红色)的频率,底部的图显示了在以增加/扩增为中心(黄色)或以丢失/缺失为中心(绿色)的计算中,HRG和LRG之间比较时每个基因的log10(P值)(双侧Fisher精确检验)。SNV,单核苷酸变异;DLBCL,弥漫性大B细胞淋巴瘤;HRG,高风险组;LRG,低风险组。
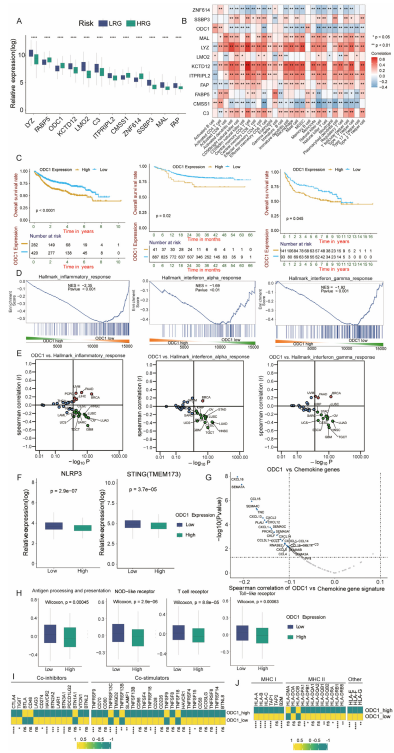
图6:ODC1的上调促进HRG - DLBCL的免疫荒漠表型
(A)HRG和LRG之间构建风险模型的12个基因的表达。
(B)DLBCL中12个基因中的每个基因与每种TME浸润先天性和适应性免疫细胞类型之间的相关性。蓝色表示负相关,红色表示正相关。
(C)基于相同的截断值7.9483,多队列的总体生存的Kaplan - Meier生存分析表明,ODC1的过表达与DLBCL训练(左图)、GSE117556(中图)和TCGA - NCICCR(右图)队列中的不良预后相关。
(D)ODC1高表达与低表达的DLBCL中炎症和干扰素反应途径的GSEA。
(E)泛癌分析中ODC1表达水平与炎症和干扰素反应途径的GSVA富集分数之间的相关性分析。
(F)ODC1高表达与低表达的DLBCL中两种先天性免疫感应因子,STING和NLRP3炎性小体的表达。
(G)DLBCL中ODC1表达水平与趋化因子基因之间的相关性分析。
(H)(H)ODC1高表达和低表达的DLBCL之间免疫激活途径的差异。
(I - J)ODC1高表达和低表达的DLBCL之间免疫共抑制剂和共刺激剂(I)以及MHC分子(J)的平均mRNA表达水平。
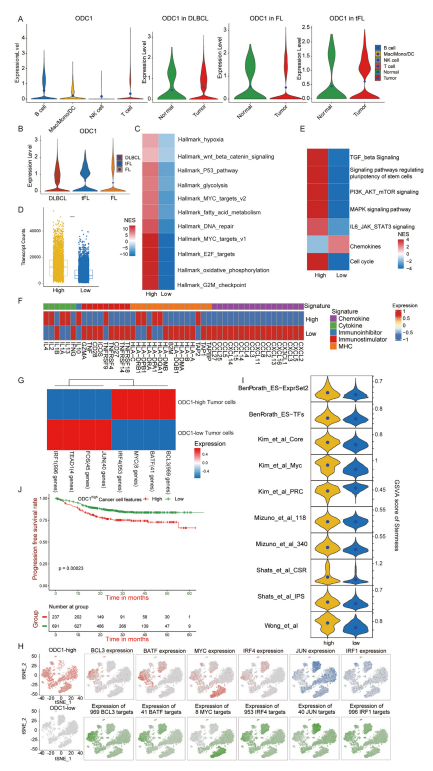
图7:ODC1 上调对弥漫性大 B 细胞淋巴瘤(DLBCL)肿瘤细胞的影响
(A)在 20 个单细胞 RNA 测序样本中不同细胞类型间 ODC1 表达的比较,以及在各种 B 细胞淋巴瘤中肿瘤细胞与正常 B 细胞间 ODC1 表达的比较。
(B)比较 DLBCL、滤泡性淋巴瘤(FL)和转化型滤泡性淋巴瘤(tFL)中肿瘤细胞的 ODC1 表达。
(C)热图展示了 DLBCL 中 ODC1 高表达与低表达的肿瘤细胞中癌症标志特征的基因集富集分析(GSEA)标准化富集分数。
(D)箱线图显示了 DLBCL 中 ODC1 高表达的肿瘤细胞中转录本计数的增加。
(E)热图展示了 DLBCL 中 ODC1 高表达与低表达的肿瘤细胞中细胞周期、趋化因子和干细胞相关通路的 GSEA 标准化富集分数。
(F)热图显示了 ODC1 高表达与低表达的肿瘤细胞中免疫激活和免疫细胞趋化途径相关基因的平均表达。
(G)热图展示了使用 SCENIC 估计的转录因子表达调控的曲线下面积(AUC)分数。
(H)对 ODC1 高表达与低表达的肿瘤细胞中转录因子表达(上图)以及这些转录因子估计的调节子活性的 AUC(下图)进行的 T 分布随机邻域嵌入(t-SNE)分析,对应于其靶基因的表达调控程度。
(I)小提琴图展示了 DLBCL 中 ODC1 高表达与低表达的肿瘤细胞中干性特征的基因集变异分析(GSVA)富集分数。
(J)Kaplan-Meier 生存分析表明,ODC1 高表达的肿瘤细胞与 DLBCL 的不良预后相关。
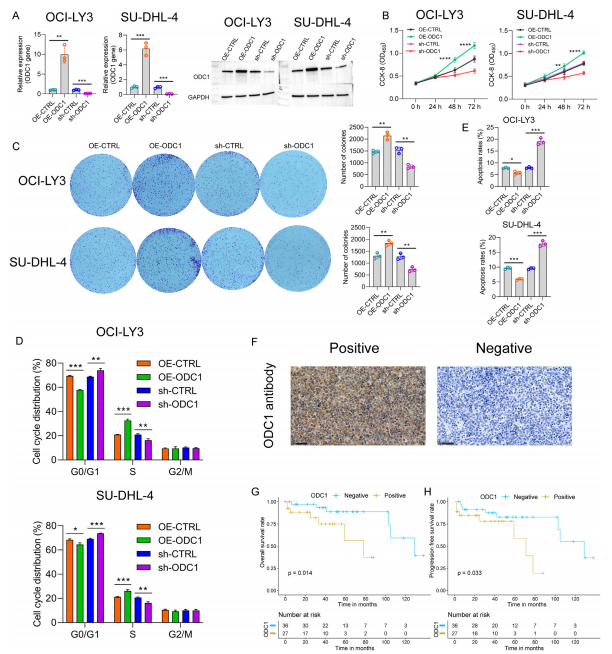
图8:ODC1 对弥漫性大 B 细胞淋巴瘤(DLBCL)细胞系中细胞增殖、细胞周期和细胞凋亡的影响
(A)在 DLBCL 细胞系 OCI-LY3 和 SU-DHL-4 中进行了质粒介导的 ODC1 过表达(OE - ODC1)和敲低(sh - ODC1)。通过 qRT-PCR 和 Western blotting 分别检测 ODC1 的 mRNA(非配对 t 检验)和蛋白表达水平。
(B,C)使用 CCK - 8 实验(B,方差分析检验)和集落形成实验(C,非配对 t 检验)评估 ODC1 过表达和敲低对细胞活力和增殖的影响。
(D)通过流式细胞术分析测量并量化细胞周期分布(非配对 t 检验)。
(E)通过膜联蛋白 V / 7 - AAD 染色评估细胞凋亡率,并使用流式细胞术进行量化(非配对 t 检验)。
(F)DLBCL 组织样本中 ODC1 表达的代表性免疫组化图像。比例尺,50μm。
(G,H)ODC1 阳性表达与阴性表达的 DLBCL 患者的总生存期
(G)和无进展生存期(H)的生存曲线(对数秩检验)。

图9:单细胞分析表明ODC1的过表达促进弥漫性大B细胞淋巴瘤(DLBCL)中M2型巨噬细胞极化
(A)对DLBCL单细胞样本中的巨噬细胞进行重新聚类。
(B)小提琴图显示在聚类1的巨噬细胞中ODC1的mRNA水平增加。
(C)对聚类0和聚类1进行基因本体(GO)富集分析。
(D)点图展示了聚类0和聚类1巨噬细胞中共刺激和MHC分子以及共抑制分子的标志物表达。
(E)热图展示了聚类0和聚类1巨噬细胞中免疫反应通路的基因集变异分析(GSVA)富集分数(Wilcoxon秩和检验,*P < 0.05;**P < 0.01;***P < 0.001;****P < 0.0001)。
(F)对聚类0和聚类1巨噬细胞中的糖酵解、炎症和干扰素反应通路进行基因集富集分析(GSEA)。
(G)小提琴图展示了聚类0和聚类1巨噬细胞中M1和M2型巨噬细胞标志物的表达。
(H)聚类0和聚类1巨噬细胞的小提琴图,用于展示MYC和TCF7L2的表达(左图),以及这些转录因子估计的调节子活性的曲线下面积(右图),对应于其靶基因的表达调控程度。(I)Kaplan-Meier生存分析表明,聚类1巨噬细胞与DLBCL的不良预后相关。NES,标准化富集分数。
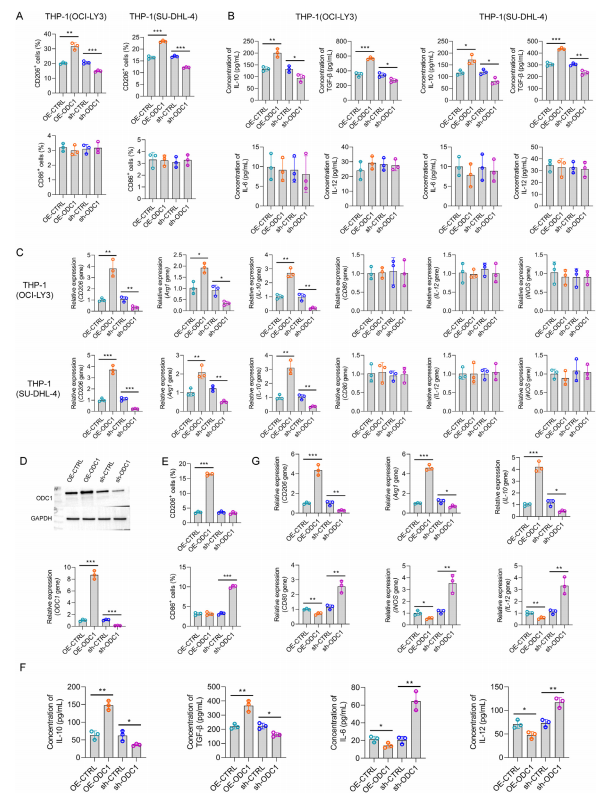
图10:体外实验证明ODC1对巨噬细胞极化的影响
(A)将M0型THP - 1细胞与过表达或敲低ODC1的弥漫性大B细胞淋巴瘤(DLBCL)细胞系共培养后,通过流式细胞术分析CD206 + M2型巨噬细胞和CD86 + M1型巨噬细胞。
(B)用ELISA法检测与不同DLBCL细胞系共培养后的上清液中细胞因子水平。
(C)用RT - PCR分析与不同DLBCL细胞系共培养后巨噬细胞中M1 / M2标记基因的表达。(D)在THP - 1细胞系中进行质粒介导的ODC1过表达和敲低,并用Western blotting(上图)和RT - PCR(下图)检测ODC1蛋白表达和mRNA水平。
(D)对ODC1表达有差异的THP - 1细胞中CD206 + M2型巨噬细胞和CD86 + M1型巨噬细胞进行流式细胞术分析。
(E)用ELISA法检测ODC1表达有差异的THP - 1细胞上清液中的细胞因子水平。
(G)用RT - PCR分析不同组巨噬细胞中M1 / M2标记基因的表达。采用非配对t检验评估两组间的统计学差异。
确定了具有干细胞样特征和不良预后的DLBCL亚组,ODC1是该高风险组的治疗弱点,其过表达和抑制分别产生不同影响。
评估了12标记风险模型在DLBCL临床实践中的意义,包括强大的风险分层能力、比传统分类更好的预后分层表现、可作为现有分类的补充以及易于应用于临床。
通过分析发现HRG - DLBCL的生物学行为具有类似BL的特征,冷免疫浸润导致高干性和定义了冷免疫致癌去分化样亚组,且该亚组可能对免疫治疗有潜在耐药性,风险模型可有效评估免疫治疗反应。
ODC1在DLBCL中研究较少,本研究揭示其可促进DLBCL的恶性增殖和免疫表型,过表达会激活多种信号通路,导致细胞因子变化和巨噬细胞极化,同时提到多胺代谢相关内容。
DFMO是多胺代谢抑制剂,在癌症治疗中有一定潜力,与PTIs联合使用或与无多胺饮食结合可增强疗效,在高风险神经母细胞瘤治疗中有积极效果,HRG - DLBCL是PBT的有力候选者,PBT与免疫治疗结合为DLBCL免疫治疗调节提供新见解。
强调本研究推进了DLBCL的精确风险分层,未来研究应注重结果的功能解释和在临床试验中验证。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:隔空操控生命分子?Science新研究:电磁脉冲可精准分裂蛋白质,改写细胞行为
下一篇:荧光手术突破!小鼠脑瘤生存期大幅延长,临床治疗新希望