常见细胞污染类型如何辨别及预防解决方法
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
发布时间:2025-03-21 17:00:47 细胞资源库平台 访问量:163
英文标题:Development of a novel HER2-CAR monocyte cell therapy with controllable proliferation and enhanced anti-tumor efficacy
中文标题:具有可控增殖和增强抗肿瘤疗效的新型HER2-CAR单核细胞疗法的开发
发表期刊:《Chinese Medical Journal》
影响因子:6.1
作者单位:北京大学第五临床医学院、中国医学科学院老年医学研究所、北京大学第九临床医学院北京世纪坛医院妇产科
作者信息:Bing Yang, Xiaoxue Wang, Xundong Wei, Jie Ma.
1. 细胞免疫疗法,特别是CAR-T细胞疗法,对血液恶性肿瘤有效,但在实体肿瘤治疗上存在挑战。
2. 实体肿瘤的复杂基质和免疫抑制环境限制了CAR-T细胞的作用,且可能引发严重毒性反应。
3. 开发新的CAR细胞策略是克服实体肿瘤治疗挑战的关键。
4. 巨噬细胞在肿瘤微环境中富集,提示它们可能有助于肿瘤治疗。
5. 自体巨噬细胞输注虽安全,但抗肿瘤效果有限。
6. 工程化单核细胞为CARs是一种有前景的治疗策略。
7. CAR-M细胞疗法的发展受限于单核细胞来源的稀缺。
8. THP1细胞系被用作开发新型CAR-M的细胞来源。
9. iCasp9自杀基因的应用有助于控制CAR-M细胞的增殖和安全性。
10. 新型CAR-M细胞有望结合天然免疫和适应性免疫,提高治疗效果。
细胞培养:THP-1、SKOV3和NCI-N87细胞经过短串联重复(STR)验证。所有细胞系在含有5% CO2的37°C湿润环境中培养。
iCasp9-THP1细胞构建:使用商业化的pCDH-EF1-MCS-T2A-Puro质粒,通过插入iCasp9-furin P2A-GFP或iCasp9-furin P2A-luciferase构建细胞。使用第三代慢病毒包装向量在HEK-293FT细胞中包装慢病毒,感染THP1细胞,并通过流式细胞术评估iCasp9表达效率。
HER2-CAR细胞构建:HER2-CAR主骨架遵循第一代经典结构,包含1× FLAG、抗体Fab段、CD8α铰链和跨膜区、CD3ζ细胞内段、CD147细胞内段和/或4-1 BB细胞内段。在HEK-293FT细胞中产生表达HER2-CAR的慢病毒,感染THP1细胞,并通过流式细胞术评估HER2-CAR表达效率。
细胞活力测定:细胞与不同浓度的AP1903处理,通过凋亡试剂盒染色后,使用流式细胞术评估细胞活力。
特异性吞噬测定:THP1细胞与SKOV3细胞共培养,通过流式细胞术评估THP1对SKOV3的特异性吞噬率。
乳酸脱氢酶(LDH)释放基于细胞毒性测定:THP1细胞与SKOV3细胞共培养后,收集细胞上清液,使用LDH检测试剂盒评估细胞损伤。
人MMP-13酶联免疫吸附测定(ELISA):THP1细胞培养在含有HER2蛋白的低血清培养基中,收集细胞上清液,使用MMP13-ELISA试剂盒检测MMP13分泌水平。
转录组测序:从CAR-THP1或Con-THP1细胞中提取总RNA,进行质量评估和量化,然后构建测序库并进行测序。
小鼠模型:使用免疫缺陷的BALB/c-nude小鼠和NOD.CB17-Prkdcscid Il2rgtm1/Bcgen小鼠建立小鼠模型。
多重免疫荧光染色:使用多重免疫荧光染色试剂盒对样本进行染色,通过荧光显微镜观察。
统计分析:使用GraphPad Prism 8.0或R软件进行统计分析,结果以平均值±标准偏差(SD)表示,使用双尾Student's t检验(两组,假设方差齐性)进行检验。所有图表使用GraphPad Prism 8.0和R绘制。P<0.05被认为具有统计学意义。
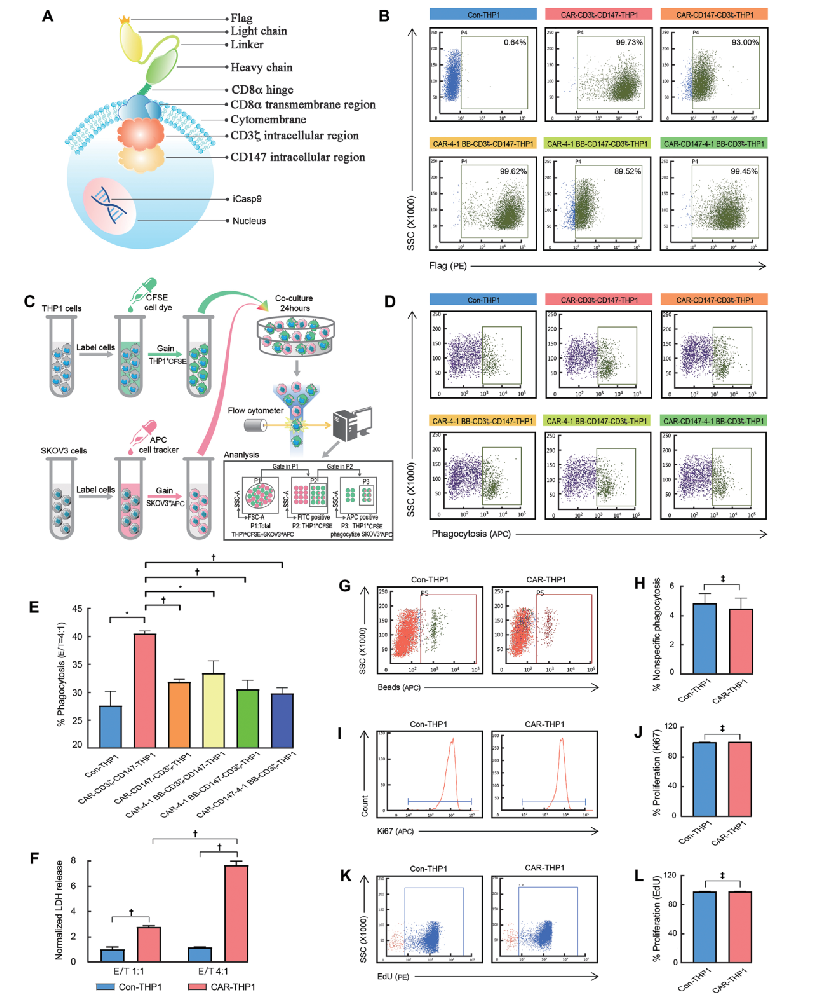
图1:重组HER2-CAR THP1细胞的构建和筛选
- (A)展示了CAR-THP1构建的流程图。
- (B)通过流式细胞仪检测不同CAR组合的FLAG标签表达效率。
- (C)描述了特异性吞噬作用实验的方案。
- (D,E)展示了Con-THP1和CARs-THP1对SKOV3细胞的特定吞噬作用。
- (F)通过LDH释放实验评估Con-THP1或CAR-THP1对SKOV3细胞的杀伤能力。
- (G,H)分析了Con-THP1和CAR-THP1之间的非特异性吞噬能力。
- (I–L)通过Ki-67染色和EdU掺入实验分析了Con-THP1和CAR-THP1的增殖能力。
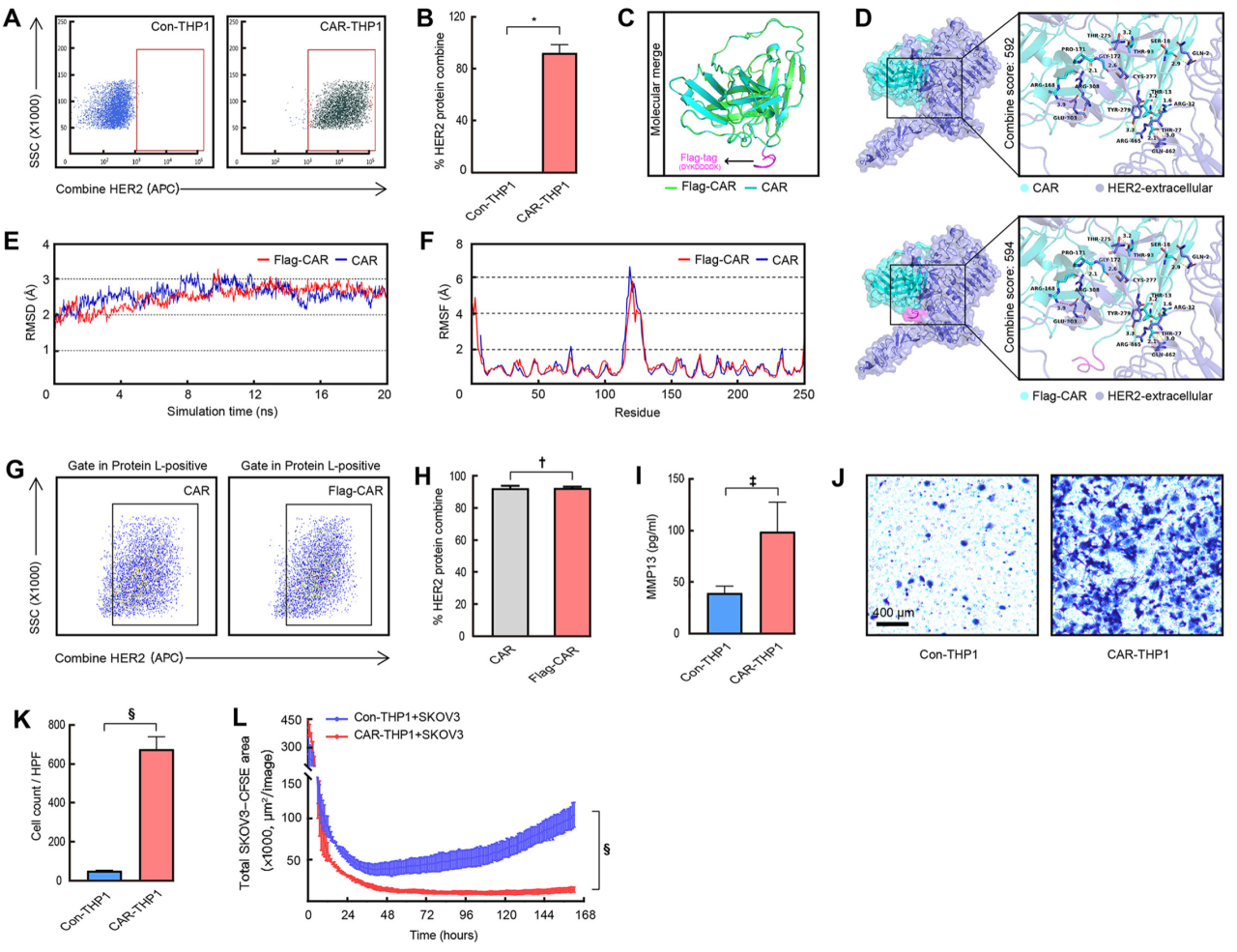
图2:CAR-THP1在体外的功能验证
- (A,B)通过流式细胞仪检测Con-THP1和CAR-THP1对HER2蛋白的特异性结合率。
- (C)展示了CAR和FLAG-CAR蛋白质的空间结构合并图。
- (D)展示了CAR和FLAG-CAR与HER2-细胞外蛋白的分子对接结果。
- (E,F)通过分子动力学模拟展示了CAR和FLAG-CAR与HER2-细胞外蛋白的结合情况。
- (G,H)通过流式细胞仪检测CAR-HEK293FT和FLAG-CAR-HEK293FT对HER2蛋白的特异性结合率。
- (I)通过ELISAs检测MMP13的分泌水平。
- (J,K)使用Transwell板 coated with matrix 分析侵袭能力。
- (L)通过共培养跟踪SKOV3细胞生长评估抗肿瘤效率。
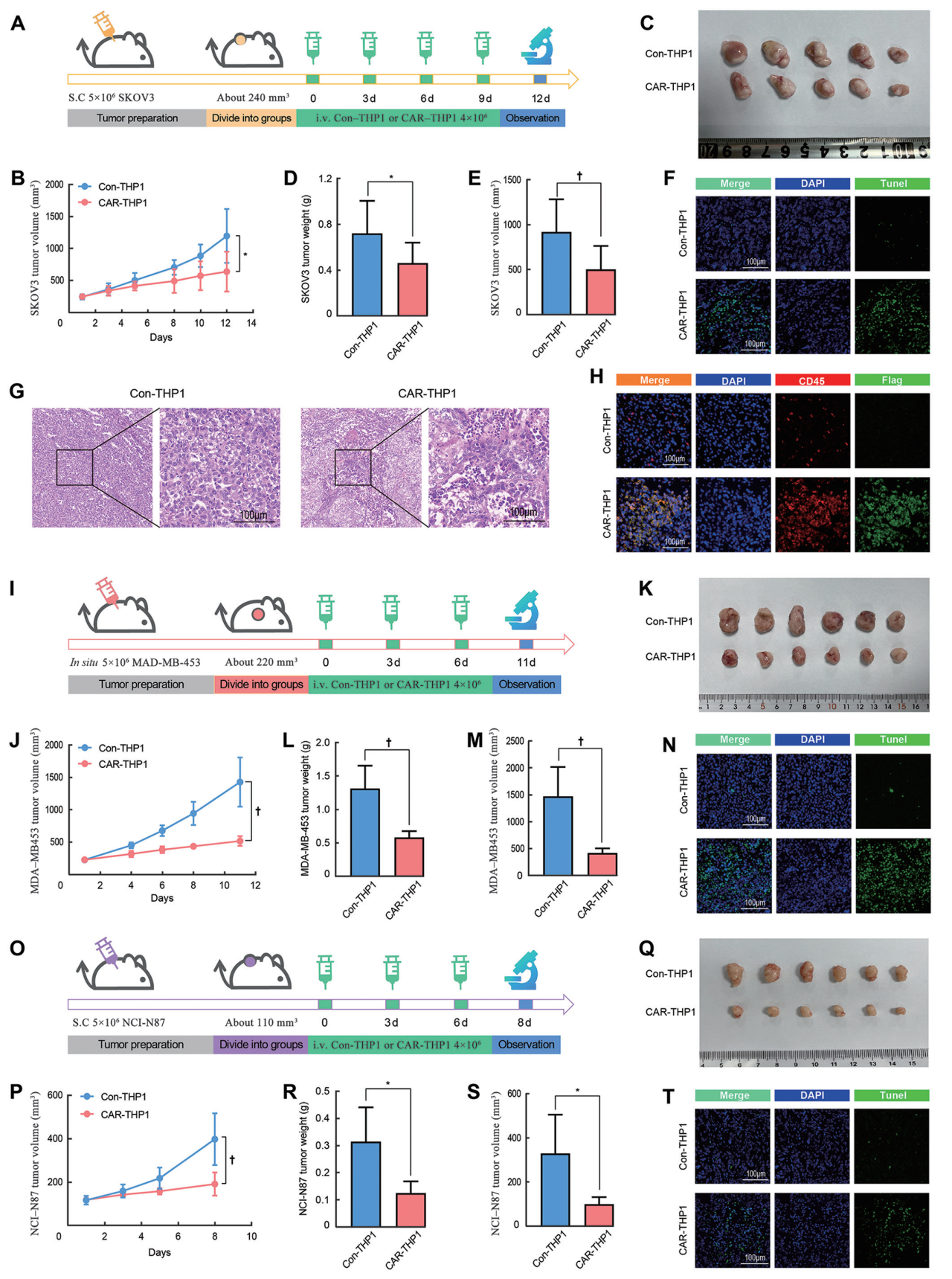
图3:CAR-THP1细胞在体内的抗肿瘤效果
- (A)描述了裸鼠皮下SKOV3卵巢癌异种移植模型的治疗方案。
- (B)展示SKOV3肿瘤生长曲线。
- (C–E)展示了裸鼠皮下SKOV3肿瘤组织在最后一天的照片及其重量和体积统计图表。
- (F)通过TUNEL染色评估肿瘤细胞凋亡。
- (G)通过H&E染色评估肿瘤组织结构。
- (H)通过多重免疫荧光染色评估肿瘤组织中的免疫细胞浸润情况。
- (I)描述了裸鼠皮下MDA-MB-453乳腺癌异种移植模型的治疗方案。
- (J)展示MDA-MB-453肿瘤生长曲线。
- (K–M)展示了裸鼠皮下MDA-MB-453肿瘤组织在最后一天的照片及其重量和体积统计图表。
- (N)通过TUNEL染色评估肿瘤细胞凋亡。
- (O)描述了裸鼠皮下NCI-N87胃癌异种移植模型的治疗方案。
- (P)展示NCI-N87肿瘤生长曲线。
- (Q–S)展示了裸鼠皮下NCI-N87肿瘤组织在最后一天的照片及其重量和体积统计图表。
- (T)通过TUNEL染色评估肿瘤细胞凋亡。
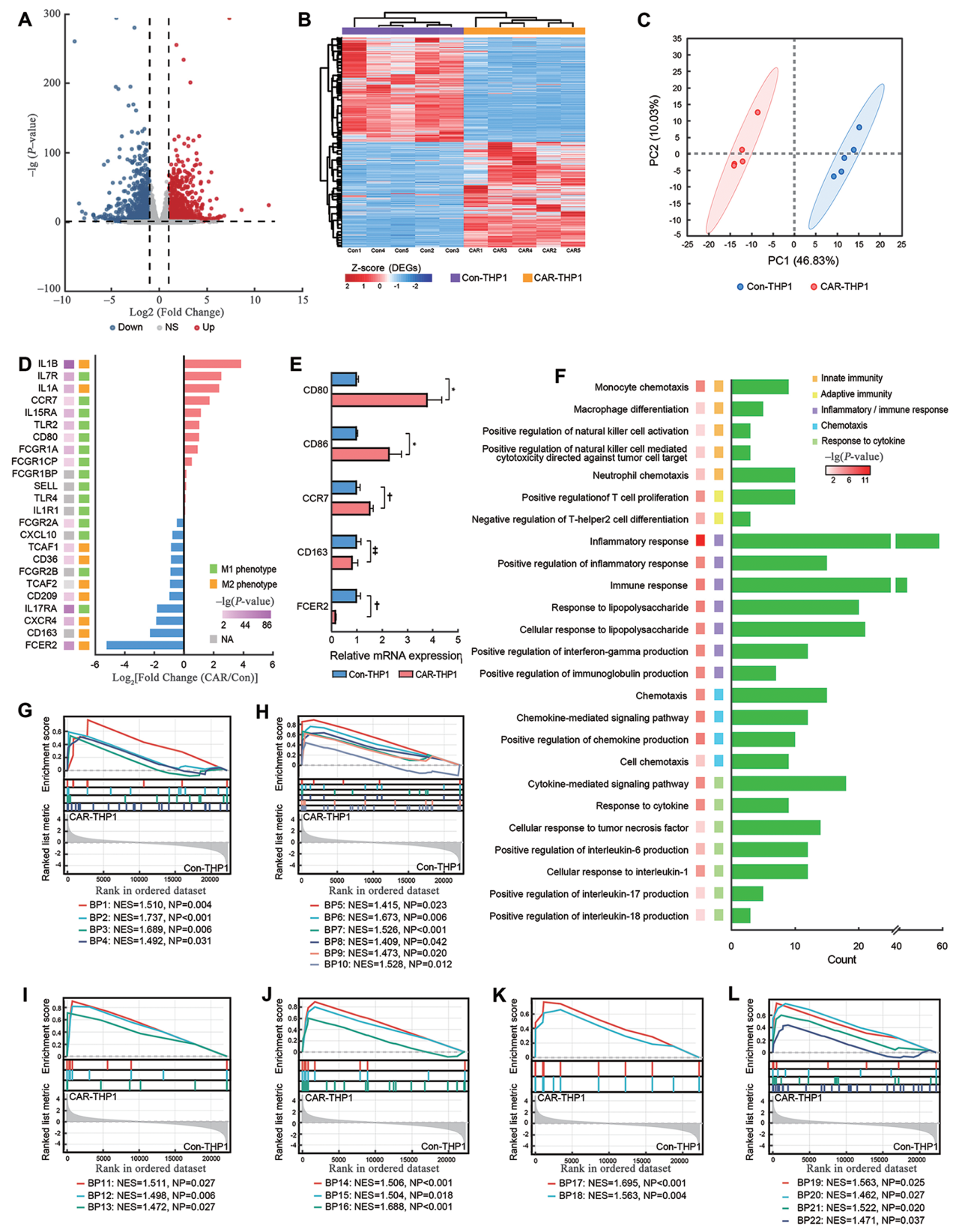
图4:CAR-THP1激活后的转录组变化
- (A)展示了CAR-THP1/Con-THP1比较的DEGs火山图。
- (B)展示了CAR-THP1/Con-THP1比较的DEGs热图。
- (C)展示了CAR-THP1和Con-THP1间基因表达差异的PCA图。
- (D)展示了M1和M2相关基因表达的条形图。
- (E)通过qPCR验证了Con-THP1和CAR-THP1共培养后SKOV3细胞上M1和M2标记物的表达水平。
- (F)展示了GO功能注释分析中1465个上调DEGs的BP term富集情况。
- (G–L)展示了GSEA分析结果,主要富集于巨噬细胞/单核细胞激活和产生、NK细胞、NKT细胞、Th17细胞、补体和相关细胞因子等方面。
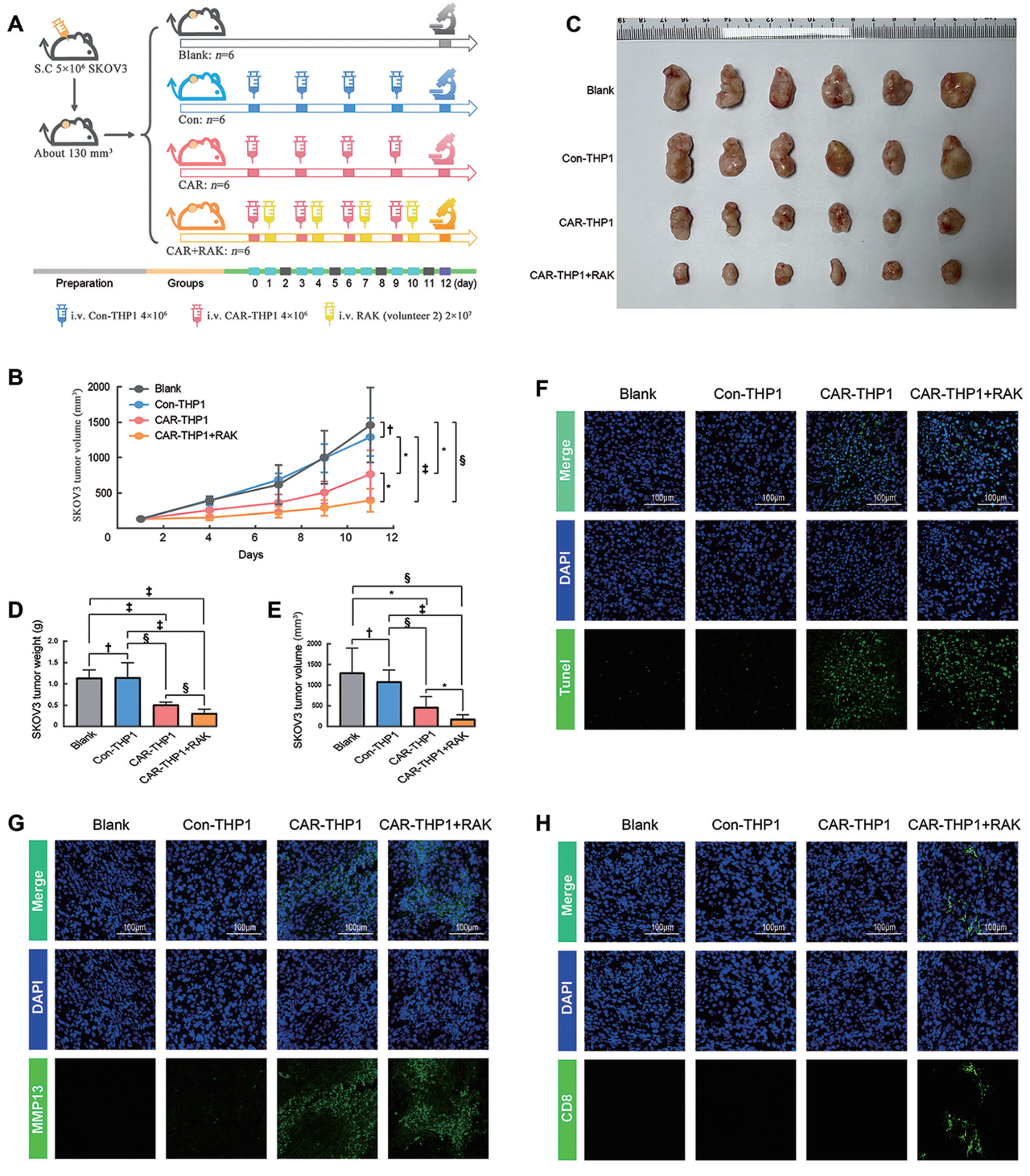
图5:CAR-THP1与RAK免疫疗法结合具有更好的治疗效果
- (A)描述了裸鼠皮下SKOV3卵巢癌异种移植模型的治疗方案,每组6只小鼠。
- (B)展示了经过初始治疗后SKOV3肿瘤的生长曲线。
- (C–E)在治疗的最后一天,展示了裸鼠皮下SKOV3肿瘤组织的照片及其重量和体积的统计图表。
- (F)通过TUNEL染色评估SKOV3肿瘤组织的细胞凋亡情况,绿色代表TUNEL阳性的凋亡细胞。
- (G)通过免疫荧光染色检测SKOV3肿瘤组织中MMP13的表达情况,绿色代表MMP13阳性的细胞。
- (H)通过免疫荧光染色检测SKOV3肿瘤组织中RAK细胞的浸润情况,绿色代表CD8阳性T细胞。
- 比例尺=100 µm。*P <0.05, †P >0.05(不显著),‡P <0.001, §P <0.01。CAR:嵌合抗原受体;MMP:金属蛋白酶;NES:标准化富集分数;DAPI:4′,6-二氨基苯丙烷;i.v.:静脉注射;S.C.:皮下注射;TUNEL:末端脱氧核糖核苷酸转移酶dUTP切割末端标记。
1. 本研究构建了一种能特异性消除肿瘤的CAR单核细胞(CAR-THP1),增强了先天性和适应性抗肿瘤免疫反应。
2. 通过比较不同的CAR组合,选择了CD3ζ-CD147构型作为最优方案,它具有最佳的吞噬效率。
3. 利用永生化的人类单核细胞系THP1作为CAR-M的细胞来源,解决了自体单核细胞数量有限的挑战。
4. iCasp9自杀基因的引入,为控制CAR-THP1的潜在不规范增殖提供了可能。
5. CAR-THP1在体内外均表现出M1表型,能够帮助改造肿瘤微环境为促炎状态。
6. CAR-THP1能够独立于T细胞存在发挥抗肿瘤作用,适合免疫功能不全的患者。
7. CAR-THP1能够作为细胞治疗的先导,促进T细胞肿瘤内浸润,与其他免疫治疗协同作用。
8. 本研究为未来的通用CAR-M疗法开发提供了有价值的参考。
9. CAR-THP1的特异性杀伤机制、安全性和疗效还需进一步研究。
常见细胞污染类型如何辨别及预防解决方法:细胞培养中常见的生物污染类型有7种,分别是细菌污染,支原体污染,原虫污染,黑胶虫污染,真菌污染,病毒污染以及非细胞污染,真菌污染来源,一般是来自实验服,并且具有气候性,多雨······
细胞聚团的原因分析及如何避免:培养物中细胞可能聚集的一些原因包括:1.过度消化、2.环境压力、3.组织分解、4.过度生长、5.污染等;如何避免聚团细胞的生成;首先确认当前细胞生长密度及状态,80%左右的生长密度即可进行······
细胞有空泡原因分析及解决方法:出现细胞空泡情况有1.细胞老化2.培养液错误配制;3.细胞消化时操作不当;4.污染等等,如细胞老化,解决方法,原代细胞使用较低代次进行实验,传代细胞避免传代次数过高···
细胞半换液和全换液操作步骤:第一种方式:细胞全换液;如果是贴壁细胞,可以用全量换液法,直接吸去全部旧培养基,补充足量新鲜完全培养基;第二种方式:细胞半换液;"细胞半换液"又称"细胞半量换液",即弃掉一半旧的培养基,再······
细胞生长缓慢的可能原因有哪些:细胞培养外部因素包括细胞培养基的配方和质量问题,培养条件不理想,污染问题,细胞自身因素包含细胞的健康状态,细胞密度过高或过低,细胞老化现象,细胞特性,当细胞生长出现缓慢的问题时,我······
常用胰腺癌细胞株动物模型及胰腺癌细胞株有哪些:胰腺癌研究中常用的动物模型主要包括化学物质诱导胰腺癌动物模型,基因工程胰腺癌小鼠模型和胰腺癌移植模型,常用的胰腺细胞株MIA-PACA-2人胰腺癌细胞,Capan-2人胰腺癌细······
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
产品规格:1*10^6
¥3000
上一篇:药物引发的聚硫辛酸聚合物结合主客体相互作用用于癌症联合化疗
下一篇:基于功能性核酸的人工囊泡包裹复合纳米颗粒的构建及其在视网膜母细胞瘤靶向诊疗中的应用